08届高三化学第一学期联考后综合训练13
1.最近日本科学家确认世界上还存在的另一种“分子足球”N60,它与C60的结构相似。下列说法正确的是
A.N60是一种新型化合物 B.N60和14N都是氮的同位素
C.N60和N2是同素异形体 D.N60和N2是同系物
2.右表为元素周期表短周期的一部分,下列有关A、B、C、D四种元素的叙述正确的是
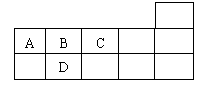 A.原子半径大小比较为A>B>C>D
A.原子半径大小比较为A>B>C>D
B.生成的氢化物稳定性为A>B>C>D
C.A与C形成的阴离子可能有AC32-、A2C42-
D.A、B、C、D的单质常温下均不导电
3.下列表述正确的是
A.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
B.化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是Al2O3
C.提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
D.用于现代通讯的光导纤维的主要成分是高纯度的硅
4.某溶液可能含有K+、Ag+、A13+、AlO2-、S2-、CO32-、SO32-、NO3-等离子中的数种。向此溶液中加入稀盐酸,有浅黄色沉淀和气体出现,此溶液的焰色反应为紫色(透过蓝色钴玻璃)。根据以上实验现象,下列结论中错误的是
A.此溶液中一定有S2-、SO32-、K+ B.此溶液中可能有AlO2-、CO32-
C.此溶液中一定没有Ag+、A13+ D.此溶液中可能有S2-、NO3-
5.下列说法中,不正确的是
A.在NaAlO2溶液中,HSO3-(H2SO3的电离常数K1=1.5×10-2;K2=1.0×10-7)不能大量存在
B.在0.1mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
6.a mol FeS与b
mol FeO投入到V
L、C
mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为A.(a+b)×63g B.(a+b)×189g C.(a+b)mol
D.(CV-![]() )mol
)mol
7.物质的量浓度各为0.1mol·L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性。下列关系式正确的是
A.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) B.c(CH3COO-)+c(CH3COOH)=0.2mol·L-1
C.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
8.已知反应![]() 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是
A. ![]() 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B. ![]() 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C. ![]() 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D. ![]() 水溶液的导电性强,因此
水溶液的导电性强,因此![]() 一定是离子化合物
一定是离子化合物
9.(12分)用示意图中的简易装置可以进行气体的发生和收集。
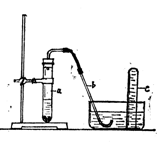 (1)实验前检查装置的气密性的方法是:
。
(1)实验前检查装置的气密性的方法是:
。
(2)拔开试管的橡皮塞,加入10 mL 6 mol/L稀硝酸和 1 g 薄铜片,
将带有导管的橡皮塞塞紧试管口。反应开始时速度缓慢,随着反应的进行逐渐加快,
在试管a中所发生的反应的化学方程式:
① ,
② 。
(3)从反应开始到反应结束,预期在试管a中可观察到象的现象是
(依次写出用序号标明):
(4)在反应开始时,可观察到导管b中的水面先沿导管b慢慢上升到一定高度,此后又回落,然后有气泡从管口冒出。反应开始时导管中水面上升的原因是:
。
(5)试管c收集满气体后,某同学用橡皮塞堵住管口,取出水槽。将管口朝上,拔开橡胶塞,片刻后,再次堵住管口,将试管又再倒置于水槽中,拔开橡皮塞。此时观察到的现象是:
。
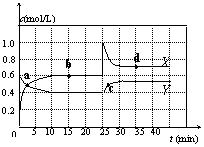
![]() 10.(10分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
10.(10分)已知NO2和N2O4可以相互转化:2NO2(g)
N2O4(g); △H<0。现将一定量NO2和N2O4的混合气体通入一定体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
(1)图中共有两条曲线X和Y,其中曲线 表示NO2
浓度随时间的变化;a、b、c、d四个点中,表示化学
反应处于平衡状态的点是 。
(2)① 前10min内用NO2表示的化学反应速率
v(NO2)= mol/(L·min)
![]() ② 15min时,反应2NO2(g) N2O4(g)在b点的浓度 平衡常数K(b)=
② 15min时,反应2NO2(g) N2O4(g)在b点的浓度 平衡常数K(b)=
![]() ③ 35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d) K(b)
③ 35min时,反应2NO2(g) N2O4(g)在d点的浓度平衡常数K(d) K(b)
(填“>”、“=”或“<”)
(3)① 若要达到使NO2(s)的百分含量与d点相同的化学平衡状态,在25min时还可以采取的措施是 。
A、加入催化剂 B、缩小容器体积 C、升高温度 D、加入一定量的N2O4
② 若在35min时,保持温度不变,快速缩小玻璃容器的体积至1L,气体的颜色变化过程是 。
11.(10分)短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个未成对电子。
(1)C原子的电子排布式为 ,若A为非金属元素,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)当n=2时,B位于元素周期表的第 周期 族,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
综合训练(12)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | C | A | C | BD | AC | AC |
9.(共12分) (1)若把导管b的下端浸入水中,用手紧握捂热试管a(或微微给试管a加热),导管口有气泡冒出;松开手(或撤去热源)后,导管b中有一段水柱(或水又会回升到导管b中),说明气密性良好。(未能答出最后一个要点扣1分。其它合理答案也给分)(2分)
![]()
![]() (2)① 3Cu + 8HNO3 3Cu(NO3)2
+ 2NO↑+ 4H2O(2分)
② 2NO + O2 2NO2
(2)① 3Cu + 8HNO3 3Cu(NO3)2
+ 2NO↑+ 4H2O(2分)
② 2NO + O2 2NO2
(3)① 有无色的气泡产生,反应速度开始缓慢,逐渐加快。(1分)(注:未注明反应速度慢变快,不扣分)② 试管上部由无色变为浅棕色,又变为无色。 (1分)
(注;未注明“又变无色”者不扣分)
③ 试管a中的溶液由无色变成蓝色。(1分)④ 反应结束时,铜片全部消失(或溶解)(1分)
(4)反应开始时产生的NO和试管a上部空气中的O2作用生成NO2;NO2易溶于水并与水反应,使装置内气体压强暂时减小。所以导管中的水面会先上升至一定高度(2分)
(5)水进入试管,上升到一定高度;试管中的气体的颜色由棕红色变为无色。 (2分)
10.(10分)(1)X (1分); b和d(2分)
(2)①0.04(1分); ②Kb=10/9L/mol(共2分,单位1分);③等于(1分)
(3)①B、D(2分,多写无分);②先变深后变浅(1分)
11.(共10分)(1)1s22s22p4 (2分) σ(2分) (2)二 IVA 非极性 原子(4分)
(3) O>P>Si>Li (2分)