08届高三化学第一学期联考后综合训练(14)
1.火星探测器发回的信息表明,火星上存在针铁矿[Goethite,化学式:FeO(OH)]和黄钾铁矾[Jarosite],从而证明火星表面曾经存在过水。这一发现被《人民日报》评为2004世界十大新闻之首。已知两种矿物中铁的价态相同,则黄钾铁矾{化学式记为:KFe3(SO4)2(OH)n}中n值为
A.4 B.5 C.6 D.7
2.将5.4g Al 投入到200.0mL 2.0mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
3.下列物质能通过化合反应直接制得的是:①FeCl2 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C. 只有①③④ D.全部
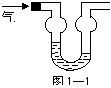 4.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。图1—1是用水吸收下列某气体时的情形,根据表1—1判断由左方进入的被吸收气体是
4.双球洗气管是一种多用途仪器,常用于去除杂质、气体干燥、气体吸收(能防止倒吸)等实验操作。图1—1是用水吸收下列某气体时的情形,根据表1—1判断由左方进入的被吸收气体是
A.Cl2 B.HCl C.H2S D.CO2
已知气体的溶解度分别为:
| 气体 | Cl2 | HCl | H2S | CO2 |
| 溶解度1:X体积 | 1:2 | 1:500 | 1:2.6 | 1:1 |
5.用NA表示阿伏加德罗常数的值,下列说法中正确的是:
A.电解CuCl2溶液,阴极析出16g铜时,电极上转移的电子数为NA
B.标准状况下,2.24 L乙醛完全燃烧所得CO2分子数为0.2 NA
C.常温常压下,22.4 L CH4分子中共价键总数为4NA
D.28g乙烯和聚乙烯的混合物完全燃烧所得CO2分子数为2 NA
6.某无色溶液与NH4HCO3作用能产生气体,此溶液中可能大量共存的离子组是:
A.Cl-、Mg2+、H+、Cu2+、SO![]() B.Na+、Ba2+、NO3-、OH
B.Na+、Ba2+、NO3-、OH![]() 、SO
、SO![]()
C.MnO![]() 、K+、Cl-、H+、SO
、K+、Cl-、H+、SO![]() D.K+、NO
D.K+、NO![]() 、SO
、SO![]() 、OH-、Na+
、OH-、Na+
7.下列离子反应方程式正确的是
A.KHCO3的水解:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.NaHSO4溶液与Ba(OH)2溶液混合呈中性:2HSO4—+Ba2++2OH—=BaSO4↓+SO42—+2H2O
C.将少量铁粉加入到过量的稀硝酸中:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
D.碳酸氢钙溶液中加入足量石灰水:Ca2++HCO3—+OH-= CaCO3↓+H2O
8.FeS2在空气中充分燃烧的化学方程式为4FeS2 + 11O2 2Fe2O3 + 8SO2,若agFeS2在空气中充分燃烧,并转移N个电子,则阿伏加德罗常数(NA)可表示为
A.120N/a B.120a/11N C.11a/120N D.120N/11a
9.科学家预言,C3N4晶体很可能具有比金刚石还大的硬度,且每个原子最外层均满足8电子稳定结构。则下列关于C3N4晶体的说法正确的是:
A.C3N4 晶体可能是分子晶体,晶体微粒间通过共价键结合
B.C3N4 晶体可能是原子晶体,具有较高的硬度
C.C3N4 晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4 晶体中N的最外层电子均参与成键
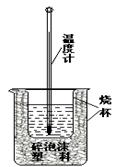 10.(10分)实验室利用如右图装置进行中和热的测定。回答下列问题:
10.(10分)实验室利用如右图装置进行中和热的测定。回答下列问题:
①该图中有两处未画出,它们是 、 ;
②在操作正确的前提下提高中和热测定的准确性的关键是 ;
③如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将 (填“偏大”、“偏小”、“不变”);原因是 。
11.(10分) 配制500 mL0.2 mol.L-1的FeSO4 溶液,实验操作步骤有:
①在天平上称取a克绿矾(FeSO4 ·7H2O),将它放在烧杯中,用适量蒸馏水使
其完全溶解 ②将所得溶液沿玻璃棒注入500 mL容量瓶中
③继续向容量瓶中加水至液面距刻度线1~2cm处,改用胶头滴管加蒸馏水
至液面底部与刻度线相切
④用少量水洗涤烧杯和玻璃棒2—3次,每次洗液都转入容量瓶 ⑤将容量瓶塞紧,充分摇匀
填写下列空白: (1)a克绿矾的实际质量为 克
(2)上述操作步骤的正确顺序为 。
(3)若配制时遗漏步骤④,会使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)。(4)若加蒸馏水时不慎超过刻度线,处理方法是
若操作步骤②时有溶液溅在窖量瓶外,处理方法是
12.(14分)A、B、C、D、E、F、G是由短周期元素组成的七种物质,其中B、C、F是单质;常温下B、C、E为气体;A物质的焰色反应呈黄色。(下图中反应②的部分产物未表示出来。)
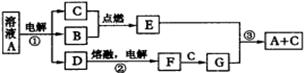
根据上图所示转化关系回答:
(1)经测定G属于离子化合物,其电子式为___________。
(2)写反应②的电极反应式:
阳极______
; 阴极
。
(3)反应③的化学方程式为
___________
。
(4)反应①的离子方程式为___________ 。
(5)这七种物质中含有共价键的有___________ (用化学式回答)
13.(8分) 能源是人类社会发展进步的物质基础。在当代,能源同信息、材料一起构成了现代文明的三大支柱。
(1)为了降低汽车尾气对大气的污染,江苏有关部门拟用甲醇替代液化石油气作为公交车的燃料。已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热akJ。请写出表示甲醇燃烧热的热化学方程式。
(2)测定工业甲醇中CH3OH的质量分数可按下法:取0.1000g工业甲醇样品,以适量H2SO4酸化后,加入20.00mL 0.2000mol/L的K2Cr2O7溶液,再用0.3000mol/L (NH4)2Fe(SO4)2标准溶液滴定,耗去此标准液20.00mL时,刚好到达滴定终点。
已知:CH3OH+Cr2O72-+8H+=CO2↑+2Cr3++6H2O
①写出H2SO4酸化的K2Cr2O7溶液与(NH4)2Fe(SO4)2溶液反应的离子方程式。
②求此工业甲醇中CH3OH的质量分数。
综合训练(14)参考答案
1.C 2.D 3.D 4.B 5.D 6.D 7.D 8.D 9.BC
10. ① 环形玻璃棒 泡沫塑料盖 ② 提高装置的保温效果 ③偏大 固体NaOH溶于水放热
11.(1)27.8 (2)①②④③⑤ (3)偏低 (4)重新配制 重新配制
12. (1)Na+[∶H]-(2分)
(2)阳极:4OH--4e-=O2↑+2H2O(2分) 阴极:4Na++4e-=4Na(2分)
(3)NaH+HCl=NaCl+H2↑(2分)(4)2Cl- + 2H2O===
2OH- + H2↑+ Cl2↑
(5)H2、Cl2、NaOH、HCl (4分)
13.(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l); △H= -725.8kJ/mol(2分)
(2) ①Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ②96% (4分)