08届高三化学第一学期联考试题
宜兴一中 高三化学备课组
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,考试时间100分钟,满分120分。
第Ⅰ卷(选择题 共48分)
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 S-32 Cl-35.5 K—39 Fe—56 As—75 I—127 Cu—64 Ag—108
一、选择题(本题包括8小题,每小题3分,共24分,每小题只有一个正确选项符合题意。)
1.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是 ( )
A. 制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
2.下列各组物质的分类正确的是 ( )
![]() A.强碱:NaOH、RbOH、Ba(OH)2
B.非电解质:SO2、氨水、C2H5OH
A.强碱:NaOH、RbOH、Ba(OH)2
B.非电解质:SO2、氨水、C2H5OH
C.碱性氧化物:MgO、Mn2O7、Na2O2 D.同系物:
3.等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是
( )
A.[M+]>[OH-]>[A-]>[H+] B.[M+]>[A-]>[H+]>[OH-]
C.[M+]>[A-]>[OH-]>[H+] D.[M+]>[H+]
=[OH-]+[A-]
4.下列有关热化学方程式的叙述中,正确的是 ( )
A.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l);△H=十57.4 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s);△H > 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g)△H=-483.6 kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1
D.已知2C(S)+2O2(g)=2CO2(g); △H1 2C(s)+O2(g)=2CO(g) △H2 则△H1<△H2
5.在反应容器中充入lmolA气体和nmolB气体,在一定条件下发生反应:A(g)+nB(g) ![]() mD (g),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
mD (g),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的![]() ,则n和m的数值可能是
( )
,则n和m的数值可能是
( )
A.n=l m=l B.n=2 m=2 C.n=3 m=3 D.n=2 m=3
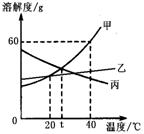 6.甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
6.甲、乙、丙三种物质(均不含结晶水)的溶解度曲线如图所示,以下说法不正确的是
A.40℃时,100g水中最多溶解甲60g
B.t℃时,甲与丙的溶解度相等
C.分别将40℃时甲、丙的饱和溶液降温至t℃,
所得两溶液中溶质的质量分数相等
D.甲中混有少量乙,可用降温结晶法分离提纯甲
7.若200mLc(H+)=1×10—3mol·L-1的某一元酸和100mL
c(OH-)=1×10—3mol·L-1的某一元碱溶液相混合后,溶液呈碱性。所用的酸和碱应是 ( )
A.等浓度的弱酸和强碱 B.稀的强酸和稀的强碱
C.稀的弱酸和浓的强碱 D.稀的强酸和浓的弱碱
8.R、M、T、G、J为原子序数依次递增的同一周期主族元素,下列说法一定正确的是(m、n均为正整数) ( )
A.若M(OH)n+1为强碱,则R(OH)n也为强碱
B.若HnJOm为强酸,则G是位于ⅤA以后的活泼非金属元素
C.若T的最低化合价为-3,则J的最高正化合价为+6
D.若M的最高正化合价为+4,则五种元素都是非金属元素
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选择符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个该小题为0分。)
9.NA代表阿伏加德罗常数值,下列说法正确的是 ( )
A.32gCu与足量的硫蒸汽充分反应,电子转移总数为1.0 NA
B.1.4 g乙烯和丙烯的混合物中含共价键数为0.3 NA
C.常温常压下,11.2L乙烷所含分子数小于0.5NA
D.2.24L(标准状况)Cl2与足量NaOH溶液在常温下反应.转移的电子数为0.2 NA
10.下列操作中,完全正确的一组是 ( )
①用试管夹夹持试管时,试管夹从试管底部上套,夹在试管的中上部
②给盛有液体的体积超过1/3容积的试管加热 ③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤取用放在细口瓶的液体时,取下瓶塞倒立放在桌面上,倾倒液体时,瓶上的标签对着地面 ⑥将烧瓶放在桌上,用力塞紧塞子 ⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管垂直伸进试管内滴加液体 ⑨稀释浓硫酸时,把水迅速倒入盛有浓硫酸的量筒中⑩检验装置的气密性时,把导管的一端浸入水中,用手捂住容器的外壁或用酒精灯微热。
A.①④⑦⑩ B.①④⑤⑦⑩ C.①④⑤⑦⑧⑩ D.④⑤⑦⑧⑩
11.某温度下,反应2NO2(g)![]() N2O4;ΔH<0在密闭容器中达到平衡,下列叙述中不正确的是(
)
N2O4;ΔH<0在密闭容器中达到平衡,下列叙述中不正确的是(
)
A.保持体积不变,加入少许N2O4,再达平衡时NO2的体积分数变小
B.保持体积不变,加入少许NO2,将使逆反应速率减小
C.加压使体积变小,将使逆反应速率增大,平衡时颜色变浅
D.保持体积不变,升高温度,再达到平衡时颜色加深
12.下列反应的离子反应方程式正确的是 ( )
A.二氧化碳通入碳酸钠溶液中 CO2+CO32-+H2O=2HCO3-
B.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH—=3Cl-+ClO—+H2O
C.硫酸亚铁溶液中加入过氧化氢溶液 Fe2++H2O2+4H+=Fe3++4H2O
D.适量的稀硫酸滴入偏铝酸钠溶液中 H++A1O2—+H2O =Al(OH)3↓
13.被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品。截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义。其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如下图所示。有关该化合物的叙述正确的是 ( )
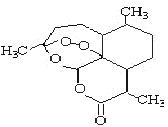
A.分子式为:C16H20O5
B.该化合物在一定条件下不能与NaOH溶液反应
C.青蒿素与维生素一样是水溶性的
D.该化合物中含有过氧键,一定条件下有氧化性
14.将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4+10OH—-8e-=CO32-+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-=8OH—,下列叙述正确的是 ( )
A.通入甲烷的电极为负极
B.正极发生氧化反应
C.该电池使用一段时间后应补充氢氧化钾
D.燃料电池工作时,溶液中的阴离子向正极移动
化学试题答案卷
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共22分)
15. (8分)碱式氯化铜(Cupric Chloride,不溶于水的绿色结晶)是一种农药,分子式:
CuCl2·3Cu(OH)2·XH2O(X=1/2,1,2)为验证其组成并确定X值,某学生设计了以下几步实验
① 取a g的晶体制成粉末。②晶体加热至确认质量不再变化为止(铜仍为二价),冷却后称
其质量为b g。③另取a g的晶体,溶于足量某溶剂中充分溶解得到溶液。④向③得到的溶液中加入足量的硝酸银溶液,最后得到纯净固体称量为c g。
若以上操作均正确,试回答下列问题:
A.将晶体制成粉末,所用的主要化学仪器 (填仪器名称,下同);
晶体应放在_________________(填仪器名称)中灼烧。
以上四步中,用到玻璃棒的步骤有 (选填:①②③④)。
B.步骤②灼烧后得到的固体应为: 。
C.步骤③所用的溶剂可能是 。
D.步骤④主要包括 加入足量硝酸银溶液→ → → 晾干→称量
E.若组成符合通式,则计算X的表达式为: (用字母表示)。
16.(14分)我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素砷的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的砷元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2%的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其中发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
(2)配平离子反应方程式:____H3AsO3+____I2+____H2O— ____H3AsO4+____I-+____H+
(3)0.2%的淀粉溶液的作用是 ,如何判断滴定到达终点?
_______________________________________________________________________。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试计算说明该中草药样品是否合格?(不需计算过程)计算可知该样品砷含量约为 mg/kg,故该草药样品 (填“合格”或“不合格”)。
四、(本题包括2小题,共24分)
17.(10分)四种短周期元素W、X、Y、Z之间可形成原子个数比均为1:1的四种化合物A、B、C、D。已知A、B均为离子晶体,构成A晶体的阴离子Y-和构成B晶体的阳离子Z+分别与Ar和Ne具有相同的核外电子排布,常温下, B与水能发生剧烈反应,生成无色气体R;由W、X两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,也放出气体R。D是由W和Z组成的离子化合物。据此回答:
(1)X是 Y是 Z是 (填元素名称)
(2)写出C的水溶液中加入MnO2所发生反应的化学方程式 向C的水溶液中滴入紫色石蕊试液充分振荡后石蕊试液褪色,说明C具有 性。
(3)化合物B的电子式为 ,形成该化合物的化学键有
(4)写出D与水反应的化学方程式 , 向反应后的溶液中滴入紫色石蕊试液,溶液显 色。
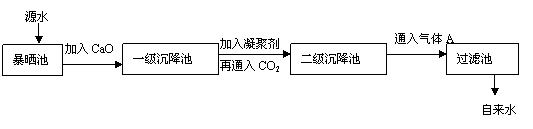 18.(14分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
18.(14分)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO后生成Ca(OH)2,进而发生若干复分解反应,试写出其中的一个离子方程式
。
(2)加入凝聚剂可以除去其中的悬浮固体颗粒,其过程是 。
(填写下列各项的序号)
①只有物理过程,无化学过程
②只有化学过程,无物理过程
③既有化学过程又有物理过程
FeSO4·7H2O是常用的凝聚剂,加入后,最终生成红褐色胶状沉淀,则这种红褐色胶状沉淀是 。
(3)通入二氧化碳的目的是
和 。
(4)气体A的作用是 。
(5)下列物质中, 可以作为气体A的代替品。(填写下列各项的序号)
①ClO2 ②浓氨水 ③SO2 ④浓硫酸
五、(本题包括1小题,共12分)
19.已知![]() ,有机玻璃可按下列路线合成:
,有机玻璃可按下列路线合成:
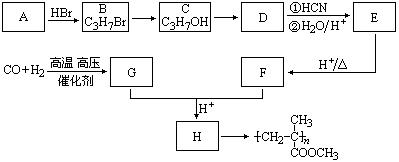
试写出:
⑴A、E的结构简式分别为:
、 。
⑵B→C、E→F的反应类型分别为:
、
⑶写出下列转化的化学方程式:C→D ;
G+F→H 。
六、(本题包括2小题,共14分)
20.(6分)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mo1/L HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的化学方程式__________________________________________。
(2)产物中硝酸铜的物质的量__________________________________mol。
(3)如混合物中含0.01 mol Cu,则含Cu2O______________________________mol
含CuO ______________________________mol。
21.(8分)在化工试剂生产中,要除去某种杂质离子,往往采用一定条件下使之生成MXAy(DE4)Z(OH)12浅黄色复盐晶体析出。化学式中OH为氢氧根,而M、A、D、E代表四种未知元素。已知⑴X+Y+Z=12(x、Y、Z为正整数)。⑵取9.7g该化合物溶于含有稀硝酸的水中,滴加硝酸钡溶液,使D、E元素完全转变为白色沉淀,过滤干燥后称量为9.32g。⑶滤液中A、M以阳离子形式存在,用胶头滴管滴滤液2—3滴在白色点滴板(或玻璃片)上,再滴加1—2滴硫氰化钾溶液,溶液呈血红色。⑷往滤液中通入足量的硫化氢气体,使A离子全部被还原后,产生黄色沉淀物,过滤干燥后,称量为0.96g。⑸化合物中A元素的百分含量为34.64%。
试通过计算推理判断:
⑴ 确定D和E:
D是 ,E是 (写元素符号)。
⑵ 确定x、y、z和A:
x==___________________y==________________z==__________________
A是____________________。
⑶ M代表的元素是______________;化合物的化学式为____________________。
化学试卷参考答案及评分标准
一、选择题(每小题有1个正确选项,每小题3分,共24分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
B | A | C | D | A | C | D | A |
二、选择题(每小题有1~2个正确选项,每小题4分,共24分)
| 9 | 10 | 11 | 12 | 13 | 14 |
| BC | A | BC | AD | D | AC |
三、(本题包括2小题,共22分)
15(8分) A.研钵 坩埚 ②③④ B.CuO C. HNO3 D.过滤 洗涤 E.![]() 或
或![]() (每空1分)
(每空1分)
16(14分,每空2分)
(1)取少量样品于坩锅内灼烧成灰,将灰转移至烧杯中并加入蒸馏水煮沸,趁热过滤,取滤液恢复至室温后得待测溶液(2分)。
(2)1,1,1,1,2,2 (2分)。
(3)作为指示剂以判断滴定的终点(2分);溶液由蓝色变为无色,保持半分钟不变色 (2分)。
(4)IO3-+5I-+6H+=3I2+3H2O(2分)。
(5)在2.278mg/kg到2.279mg/kg范围内均可得分(1分); 不合格(1分)。
四、(共24分)
17、(10分)(1)氧
氯 钠(各1分)(2)2H2O2![]() 2H2O+O2↑
(2分)氧化(1分) (3)Na+ [:O:O: ]2-Na+ 离子键和共价键(每空1分)
2H2O+O2↑
(2分)氧化(1分) (3)Na+ [:O:O: ]2-Na+ 离子键和共价键(每空1分)
(4)NaH+H2O=NaOH+H2↑
(2分) 蓝色(1分)
18.(1)只要写出下列4个离子方程式中的任意一个,即可给2分。
![]()
![]() HCO-3+OH- CO2-3+H2O;
Ca2++CO32- CaCO3↓;
HCO-3+OH- CO2-3+H2O;
Ca2++CO32- CaCO3↓;
![]() Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
Ca2++2HCO-3+2OH- CaCO3↓+CO32-+2H2O;
![]() Mg2++2OH- Mg(OH)2↓
Mg2++2OH- Mg(OH)2↓
(2)③;Fe(OH)3 (每空2分)
(3)除去钙离子;调节溶液酸度(每空2分)
(4)杀菌消毒或氧化性(每空2分)
(5)① (每空2分)
五、(12分)
19 (每空2分)
⑴CH2=CHCH3、(CH3)2C(OH)COOH ⑵加成反应、消去反应(3)略
六、(本题包括2小题,共14分)
20、(1)3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O(2分)
(2)0.025mol; (2分)
(3)0.005mo1 0.005mol (各1分)
21(8分)(每空1分)
(1)S、O
(2)2、6、4 Fe3+
(3)Na、Na2Fe6(SO4)4(OH)12