08届高三化学第一学期月考考试试题
高 三 化 学
命题人:田庆斌 校对:田庆斌
可能用到的相对原子质量:
Fe 56 Zn 65 Cu 64 S 32 O 16 H 1
第Ⅰ卷(选择题 共64分)
一、选择题(本题包括16小题,每小题只有一个选项符合题意,每小题4分,共64分)
1.仅能在水溶液中导电的物质是
A. NaOH B. NaHSO4 C. CH3CH2OH D. NaHCO3
2.设NA表示阿伏加德罗常数的值,下列说法正确的是
A.铁、铜和稀硫酸构成原电池,当转移了NA个电子时,产生的气体体积一定为11.2 L
B.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
C.关于反应C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l);△H=-1300 kJ·mol-1,有8NA个碳氧共用电子对形成时,放出1300 kJ的能量
D.在标准状况下,2.24 L的乙烷中含有共价键的数目为0.6NA
3.有五组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| ① | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O 100.0 | H2S -60.2 | (d) -42.0 | H2Te -1.8 |
| ⑤ | CH4 -161.0 | SiH4 -112.0 | GeH4 -90.0 | (e) -52.0 |
对应表中内容,下列各项中正确的是
A.a、b、c的化学式分别为Ne2、Br2、HF
B.第②组物质均有氧化性;第③组物质对应水溶液均是强酸
C.第④组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te
D.上表物质中HF和H2O由于氢键的影响,其分子特别稳定
4.高铁酸钾(K2FeO4)是一种比Cl2、O3、KMnO4氧化性更强的多功能水处理剂。工业上可先制得高铁酸钠(离子反应为2Fe(OH)3 +3C1O-+ 4OH-= 2FeO42-+ 3Cl- + 5H2O),然后在高铁酸钠溶液中加入一定量的KOH,可析出高铁酸钾。下列说法不正确的是
A.高铁酸钠溶解度比高铁酸钾大
B.每生成l mol Na2FeO4,转移3 mol电子
C.高铁酸钾不仅能消毒杀菌,还能除去水中的还原性杂质
D.高铁酸钾溶液是胶体,能吸附水中的悬浮杂质
5.磷化硼是一种超硬耐磨涂层材料。右图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是
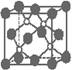 A.磷化硼晶体的化学式为BP,属于离子晶体
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4根共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
6.在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因两者都是正确的是
A.SO2氧化为SO3时采用高压(20MPa-50MPa)的生产条件,来提高SO2的转化率
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用V2O5催化剂,这样可以提高SO2的转化率
D.用98.3%的硫酸吸收SO2,目的是为了防止形成酸雾,以便使SO3吸收完全
7.下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是
| 编号 | 化学反应 | 离子方程式 | 评价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH = CO2↑+ H2O+2CH3COO- | 错误,碳酸钙是弱电解质,不应写成离子形式 |
| B | 苯酚钠溶液中通入 少量CO2 | C6H5O—+ CO2 + H2O → C6H5OH + HCO3— | 错误,通入少量CO2应生成CO32— |
| C | NaHCO3的水解 | HCO3-+H2O | 正确 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2+ + 2Br—+ 2Cl2 = 2Fe3+ + Br2 + 4Cl— | 正确 |
8.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),能使溶液与原来完全一样的是
A.CuCl2 (CuO) B.NaOH (NaOH)
C.NaCl (HCl) D.CuSO4 〔Cu(OH)2〕
9.甲、乙两烧杯中,分别盛放0.5L等物质的量浓度的稀H2SO4,向甲烧杯中加入mgFe粉,向乙烧杯中加入mg Zn粉,完全反应后,发现一烧杯中金属仍有剩余,若稀H2SO4的物质的量浓度为xmol/L,则x的范围应是
A.![]() ≥x>
≥x>![]() B.
B.![]() >x≥
>x≥![]()
C.![]() >x>
>x>![]() D.
D.![]() ≥x>
≥x>![]()
10.当两块铂金属片插入100g 10%CuSO4溶液后,通电一段时间,在阳极析出0.16g物质时,CuSO4溶液的质量分数为
A.8.47% B.8.36% C.8.73% D.9.02%
11.向铁和铜的混合物中加入不足量的稀硝酸,反应后剩余了m1g金属,再继续加入一定量的稀硫酸,充分反应后剩余了m2 g金属,则对m1 g金属组成推断正确的是
A.其中只含有铁 B.其中不可能含铁
C.其中肯定含有铜 D.其中铁和铜一定都有
12.X、Y、Z三种元素,其中有一种金属元素。X、Y原子的电子层数相同。Y、Z原子的最外层电子数相同。又知这三种元素原子的最外层电子数之和为17。原子核中的质子数之和为31。下列说法正确的是
A.X、Y、Z均为主族元素
B.XY3中所有原子均满足最外层8电子稳定结构
C.Y是非金属性最强的元素
D.Z是短周期中原子序数最大的元素
13.在273℃,404kPa下,一个盛满空气的容器的总质量为95.3g(空气的平均分子量为29),若改盛氢气其总质量为92.6g,则此容器的容积为
A.3.36 L B.2.24 L C.1.12 L D.0.56 L
14.已知IBr的性质与卤素相似,CrO5的结构为 ![]() ,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是
,次氟酸的结构为H-O-F,下列反应中属于氧化-还原反应的是
①IBr+H2O=HIO+HBr ②Cr2O72-+4H2O2+2H+=2CrO5+5H2O
③ 2HOF=2HF+O2↑
A.①②③ B.只有② C.只有③ D.无
15.将0.2 mol MnO2和50 mL 12mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A.等于0.3 mol B.小于0.3 mol
C.大于0.3 mol D.以上结论都不正确
16.四个可加热的密闭容器中,分别装有;①Na2O2和NaHCO3;②Na2O2和NH4HCO3;③Na2O2和Ca(HCO3)2;④Na2CO3和NaHCO3。各容器中每种物质均为0.5mol,现将各容器加热至300℃,完全分解后排出气体,四个容器中残留固体只有Na2CO3的容器是
A.①② B.②④ C.②③ D.①④ b
第Ⅱ卷(非选择题 共36分)
二、(本题包括6小题,共36分)
17.(4分)玻璃棒是化学实验中常用的仪器,其作用是用于搅拌、过滤或转移液体时引流。下列有关实验过程中,肯定不需要使用玻璃棒进行操作的是(填字母代号)______
A.一定溶质质量分数溶液的配制
B.用适量的蔗糖、浓硫酸和水在小烧杯中进行浓硫酸的脱水性实验
C.用普通漏斗组成的过滤装置进行过滤实验
D.实验室用FeSO4溶液和NaOH溶液制备Fe(OH)2沉淀
E.用已知浓度的盐酸和未知浓度的氢氧化钠溶液进行中和滴定实验
F.硫酸铜晶体里结晶水含量测定的实验
G.将适量氯化铁饱和溶液滴入沸水中制氢氧化铁胶体
18.(6分)20世纪80年代,科学家发现的C60分子是由60个碳原子构成的,它的形状像足球(图C),因此又叫足球烯;90年代科学家又发现一种碳的单质——碳纳米管,它是由碳原子构成的六边环形的管状大分子,其六元环结构与足球烯的六元环相似(图D),图A、图B分别是金刚石和石墨的结构示意图。图中小黑点或小黑圈均代表碳原子。
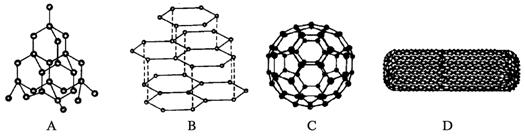
试回答下列问题:
(1)金刚石、石墨、足球烯和碳纳米管的熔点存在较大差异的原因是
_________________________________________________________________。
(2)常温下足球烯和碳纳米管的化学性质是否比金刚石和石墨活泼?_________________(填“活泼”和“不活泼”),理由是______ ___。
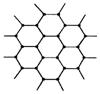 (3)由右边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C 原子数与C—C键数之比为_____________。
(3)由右边石墨的晶体结构俯视图可推算在石墨晶体中,每个正六边形平均所占有的C 原子数与C—C键数之比为_____________。
(4) 燃氢汽车之所以尚未大面积推广除较经济的制氢方法尚未完全解决外,制得H2后还需解决贮存问题。在上述四种碳单质中有可能成为贮氢材料的是__ __。
19.(2分)完成下列离子方程式(给出物质的计量数不能改变)
(1) +6H+= 2Fe3++3
(2) +Ca2++2 =CaCO3↓+
20.(3分)近年来,由于共生工程的应用,利用发电厂产生的SO2,可以制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。
(1)写出电极反应:负极反应为 ;正极反应为 。
(2)这种方法处理发电厂废气中SO2的优点是 。
21.(11分)已知A—L所代表的物质(溶液中的溶质),除B外均是中学化学里常见的物质,它们的转化关系如图所示。(反应时加入或生成水均略去)
已知:a.通常状况下,A是淡黄色固体,C是红棕色固体,D是气体单质,E是无色无味气体;b.反应②—③是工业生产L的部分反应,反应④是工业生产普通玻璃的反应之一;c.B是由两种元素组成的化合物,其质量比为7:5;请填写下列空白:
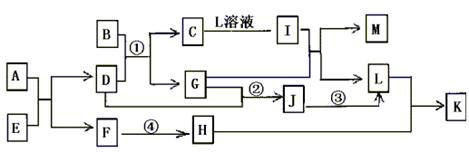
(1)A的电子式 ,B的化学式 。
(2)反应②的工业生产条件 ,写出工业生产L时反应①的设备名称 。
(3)完成下列反应方程式:
①I+G→M+L的离子方程式: ,
②反应④的化学方程式: 。
22.(10分)(1)在硫酸的工业生产中,最后的产品是质量分数为98%的硫酸或20%的发烟硫酸(H2SO4和SO3的混合物,其中含20%的SO3)。若98%的硫酸可表示为SO3•aH2O,20%的发烟硫酸可表示为H2O•bSO3,则a、b的值(a、b可用分数表示)分别是:
a b .
(2)使一定质量的锌与100 mL18.5 mol/L浓硫酸充分反应,锌完全溶解,同时生成标准状况下的气体A33.6L。将反应后的溶液稀释至1L,测得溶液PH=1。气体A中含有的气体为 ,其组成的体积比为 。
(3)FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体为ρg/cm,晶胞边长为a cm。求: FexO中x值为 。
高三化学参考答案
1-5 DCCDC 6-10 DDCBA 11-16 CDBDCB
17 ABCF
18 (1)晶体类型不同(1分) (2)活泼(1分)
足球烯和碳纳米管的原子间有C=C键(1分)
(3)2:3(1分) (4)足球烯和碳纳米管(2分)
19 (1)Fe2O3 H2O
(2)CO2 OH- (各1分)
20 (1)负极:SO2+2H2O-2e-=SO42-+4H+;正极:1/2O2+2H++2e-=H2O;
(2)减少环境污染,同时制得产品为H2SO4,一举两得。(每空1分)
21 (1)Na2O2 的电子式(2分) Fe4S5 (2分)
(2)400—500℃ 催化剂(2分) ,沸腾炉(1分)
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ (2分) Na2CO3+SiO2=Na2SiO3+CO2 (2分)
22 (1)10/9 209/160 (2)SO2和H2 1:4
(3)(ρa3NA-64)/224