08届高三化学第一学期期中统一考试
化 学 试 题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间100分钟。
注意事项:
1.回答I卷前,考生务必在答题卡和答题纸姓名栏内写上自己的姓名、考试科目、准考证号等,并用2B铅笔涂写在答题卡上。
2.每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题卡和第Ⅱ卷一并交回。
可能用到的原子量: H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5 I-127
Ba-137 Cu-64 K-39 Al -27 Ca -40 Fe-56 Mn-55 Zn-65 Be-9 Si-28
第Ⅰ卷(选择题 共48分)
选择题(本题包括16小题,每题3分,共48分。每小题只有一个选项符合题意)
1.下列有关叙述正确的是:
A、铜可导电,所以铜是电解质
B、MgCl2在熔融状态下可导电,它是电解质
C、HCl、H2SO4液态时都不导电,都是非电解质
D、能导电的单质一定是金属
2.氢叠氮酸(HN3)与醋酸性质相似,其盐稳定, 但是在受到撞击时发生爆炸生成氮气。有关氢叠氮酸及其盐的叙述不正确的是:
A、NaN3可用于汽车防撞保护囊 B、NaN3的水溶液呈碱性
C、NaN3 的固体属于离子晶体 D、HN3分子中各原子都满足于8个电子稳定结构
3.下列关于胶体说法正确的是
A、胶体都是液体
B、具有丁达尔效应是胶体的本质特征
C、胶体具有和其它分散系不同的性质,原因在于其分散质微粒大小与其它分散系不同
D、向溶胶中加入任何一种溶液,都可使溶胶发生聚沉。
4.实验室有一瓶久置的白色粉末,经元素分析证明它由钾、硫、氧三种元素组成,钾和硫的质量比39:16,下列结论正确的是
A、根据元素分析的结果推测该粉末是纯净物
B、将粉末溶于水,加入氯化钡,观察有白色的沉淀生成,证明原来的粉末是硫酸钾
C、将粉末溶于水,加入氯化钡和盐酸,观察到有白色沉淀和气泡产生,则原粉末可能是硫酸钾和亚硫酸钾的混合物
D、将粉末加入盐酸,产生气泡,证明原粉末一定是亚硫酸钾
5.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有
A.[Al(OH)4]— B.Cu2+ C.Al3+ D.Mg2+
6.对于发生反应M+N=W+V的化学反应中,下列说法正确的是
A、若M、W为单质,N、V为化合物,该反应不一定是置换反应
B、W、V为盐和水,该反应不一定是中和反应
C、若M、N为m克,则反应后W、V的质量和一定是m克
D、反应物M,N的质量比一定等于W,V的质量比
7.对下列各种溶液中所含离子的判断合理的是
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42—,Br—,OH—,Ba2+
B.在c(H+)=10—14mol/L的溶液中可能含:Na+,AlO2—,CO32—,SO32—
C.在常温下加入铝粉有氢气放出,则溶液中可能含:K+,Na+,H+,NO3—
D.使紫色石蕊试液变红色的溶液中可能含:K+,Na+,Ca2+,HCO3—
8.下列实验操作正确的是
A.粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体
B.容量瓶检漏:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置数次,观察是否漏水
C.不慎将浓苛性钠溶液沾到皮肤上,立即用H2SO4 中和并洗涤
D.测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较
9.根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是:
①向FeC13溶液中滴加KI溶液,再加入CC14振荡,CCl4层呈紫红色
②向FeC12溶液中加入氯水,再加入KSCN溶液,呈红色
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去
A.I2>C12>Fe3+>MnO4- B.MnO4->C12>Fe3+>I2
C.Cl2>I2>Fe3+>MnO4- D.Fe3+>MnO4->Cl2>I2
10.下列除去杂质的方法正确的是
A.除去N2中的少量O2:通过灼热的CuO粉末,收集气体
B.除去CO2中的少量HCl:通入Na2CO3溶液,收集气体
C除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤.
D. 除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后过滤
11. 能正确表示下列反应的离子方程式是
A.向偏铝酸钠溶液中滴加过量的碳酸氢钠溶液:AlO2—+4H+ Al3++2H2O
B.石灰水与足量碳酸氢钠溶液反应:HCO3—+Ca2++OH— CaCO3↓+H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:
2H++SO42—+Ba2++2OH— BaSO4↓+2H2O
D.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O Fe(OH)3↓+3H+
12.科学家最近发现2种粒子:第一种是只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”;第2种是由四个氧原子构成的分子。下列有关这两种粒子的说法不正确的是:
A、“四中子”不显电性 B、“四中子”的质量数为4
C、第2种粒子的化学式O4 D、第2种粒子是氧元素的另一种同位素
13.下列实验操作中,仪器需插入液面以下的有
①制备Fe(OH)2时将NaOH溶液滴入FeSO4溶液中所用的胶头滴管 ②制取H2的简易装置中长颈漏斗的下端管口 ③分馏石油时控制温度所用的温度计 ④用乙醇制备乙烯时所用的温度计 ⑤用水吸收NH3时的导气管 ⑥向试管中的BaCl2溶液中滴加稀 H2SO4所用的胶头滴管
A.③⑤⑥ B.②⑤ C.①②④ D.①②③④⑤⑥
14.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2 + Na2BeO2 + 2H2O == 2NaCl + 2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的 pH > 7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH < 7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2能溶于盐酸,不能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
15.如图,B为常见金属或非金属单质,有下列转化关系:
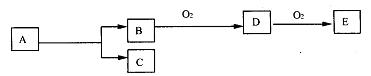
若C是可用作自来水消毒的气体,D、E是氧化物,D转化为E时,增加氧的质量约是D物质总质量的25.8%,则A是
A.AlCl3 B.H2O2 C.KCl D.NaCl
16.由Na2O2、Na2CO3、NaHCO3、NaCl中某几种组成的混合物,向其中加入足量的盐酸有气体放出。将气体通过足量的NaOH溶液,气体体积减少。将上述混合物在空气中加热,有气体放出。下列判断正确的是
A.混合物中一定不含Na2CO3、NaCl
B.混合物中一定有Na2O2、NaHCO3
C.无法确定混合物中是否含有NaHCO3
D.混合物中一定不含Na2O2、NaCl
邹城市2007--2008学年度第一学期高三期中统一考试
化 学 试 题
第II卷(非选择题 共52分)
| 题号 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | II卷得分 |
| 得分 |
|
|
|
|
|
|
|
|
|
17.(7分)实验室要配置100mL1mol./L的KOH溶液,试回答
(1)用不到的仪器是
A 烧杯 B 250mL容量瓶 C天平 D胶头滴管 E玻璃棒 F 100mL容量瓶 G漏斗
(2) 配置时要称取KOH的质量为
(3)从下面选出正确的操作并写出正确的顺序 (填序号)。
A洗涤 B干燥 C量取 D称量 E 定容 F转移溶液 G稀释 H溶解 I冷却 J摇匀
(4)实验中出现下列情况要如何处理?
A 加蒸馏水时不小心加过了刻度线 ;
B 加蒸馏水到离刻度线1~2cm处时应 。
18.(9分)某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 |
| Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 |
| Zn+Fe2+=Zn2++Fe |
|
| ③ | 在FeCl3溶液中加入足量铁粉 |
| Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
| ④ |
|
|
| Fe3+具有氧化性 |
实验结论:Fe只有还原性,Fe3+只有氧化性,Fe2+既有氧化性,又有还原性。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
A.Cl2 B.Na C.Na+ D.Cl- E.SO2 F.NO2
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该 防止亚铁盐被氧化。
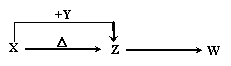 19.(7分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系
19.(7分)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系
(部分反应物、产物及反应条件已略去)。请回答:
(1)W的电子式是 。(2)X与Y在溶液中反应的离子方程式是
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用右图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。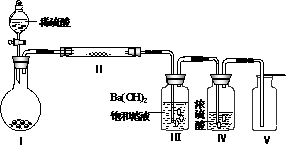 ①装置Ⅰ中反应的化学方程式是
①装置Ⅰ中反应的化学方程式是
。
装置Ⅱ中物质的化学式是 。
②用Ⅹ含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图选择必要的装置,填写编号)。
20.(5分)下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A、D为金属单质,其他为化合物。试推断:
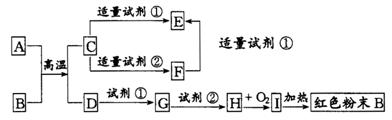
(1)写出物质的化学式:
A:_______ C:________ I:________
| 座 号 |
|
(2)写出下列反应的方程式:
C→F的离子方程式
H→I的化学方程式
21.(4分)某化学反应的反应物和产物如下:
KMnO4 + KI+ H2SO4→ MnSO4 + I2 + KIO3 + K2SO4 + H2O
(1)该反应的氧化剂是 (2)如果该反应方程式中I2和KIO3的系数都是5
①KMnO4的系数是 ②在上面的化学反应式上标出电子转移的方向和数目。
(3)如果没有对该方程式中的某些系数作限定,可能的配平系数有许多组。原因是
。
22.(9分)短周期元素形成的纯净物A、B、C、D、E是转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
|
|
|
|
|
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的一种化学式 。
(2)若E的水溶液呈现弱酸性,D是既能溶于强酸、又有溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因。
。
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系
。
(3)若C是一种气体,D是一种强酸,则:
①C与水反应的化学方程式为 。
|
为了验证该观点是否正确,用右图装置进行实验。
实验过程中,浓H2SO4中未发现有气体逸出,且变
为红棕色,则你得出的结论是 。
③已知常温下物质A与物质B生成1mol气体C的焓变为—57.07kJ, 1 mol气体C与H2O反应生成D溶液和E气体的焓变为—46kJ,写出物质A与物质B及水生成D溶液的热化学方程式 。
23.(5分)(1)可以验证镁、铝的金属性强弱的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
(2)现有MgCl2溶液、AlCl3溶液、NaOH溶液、氨水、盐酸等几种物质,试设计实验方案证明镁、铝的金属性强弱。
24.(6分)将一定量氧化铜粉末加入到100mL0.5mol/L的硫酸中,微热至氧化铜全部溶解,再向该蓝色溶液中加入铁粉10克充分反应后过滤,烘干,得干燥的固体物质仍为10克。
(1)参加反应的铁为多少克?
(2)原加入的氧化铜为多少克?
(3)最后得到的溶液仍为100mL,其物质的量浓度为多少?
高三化学试题参考答案
选择题(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | D | C | C | A | B | B | D | B | D | C | D | C | B | D | B |
17.(共7分) (1)BG(2分) (2) 5.6g(1分)(3) D、H、I、F、(J、)A、E、J(2分)
(4) 重配(1分) 改用胶头滴管滴加至刻度线(1分)
18.(共9分)(1)试管(1分)(2)①Cl2+2Fe2+=2Cl-+2Fe3+ (1分)②Fe2+有氧化性(1分) ③铁粉逐渐溶解,溶液由棕黄色变为浅绿色 (1分) ④在FeCl3溶液中加入铜片。(1分)
(3)A E F (3分) (4)在亚铁盐溶液中加入少量铁单质。(1分)
19.(共7分)(1)![]() (1分)(2)HCO3—+OH—
(1分)(2)HCO3—+OH— CO32-+H2O (1分)
(3)①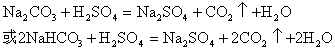 (1分) Na2O2(1分)
(1分) Na2O2(1分)
② H2O2 (1分) I、IV、V(2分)
20.(共5分)(1)A: Al; C:Al2O3; I:Fe(OH)3
(2)Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-);
4Fe(OH)2+O2+2H2O 4Fe(OH)3(每空1分)
21.(4分)(每空1分)(1)KMnO4 (2)① 8 ② 略
(3)该反应式含两种氧化产物,两者的比例和氧化剂的用量都可以发生变化
22.(9分)(1)Na2O2(NaH)(1分)
![]()
![]() (2)①H++A1O2-+H2O A1(OH)3 A13++3OH- (2分)
(2)①H++A1O2-+H2O A1(OH)3 A13++3OH- (2分)
②c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)(2分)
(3)①3NO2+H2O=2HNO3+NO(1分)
②NO2能溶于浓H2SO4,因而不能用浓H2SO4干燥NO2(1分)
③4NO(g)+3O2(g)+2H2O(1)=4HNO3(aq);△H=-618.42kJ ·mol-1(2分)
23.(5分)(1)bc (2分)
(2)分别取适量MgCl2溶液、AlCl3溶液于两支试管中,分别向两支试管中加入适量NaOH溶液或氨水,将所得沉淀分别等分为两份,分别向一份Mg(OH)2、Al(OH)3中加入适量NaOH溶液,Mg(OH)2不溶解,Al(OH)3溶解;再分别向另一份Mg(OH)2、Al(OH)3中加入适量盐酸,全部溶解,说明Mg的金属性比Al强。(3分)
24.(6分)各2分(1)2.8克 (2)3.5克 (3)0.5mol/L