08届高三化学第一学期期末模拟考试
化 学 试 题(2)
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Fe:56 Cu:64 Br:80 Ag:108
一、选择题(每题只有一个选项符合题意。每题3分,共24分)
1.下列说法正确的是( )
A.二氧化硫和氯气都易液化,因为它们的沸点很低
B.大气中二氧化硫的主要来源是化石燃料的燃烧
C.正常雨水的pH小于5.6
D.二氧化硫能使紫色的石蕊试液变红又褪色
2.在医学、日常生活中常见的溶液:①福尔马林 ②医用消毒酒精 ③生理盐水 ④食醋,这些溶液中的溶质质量分数由大到小顺序为( )
A.①②③④ B.①②④③ C.②④①③ D.②①④③
3.近期报道,中国科学家以二氧化碳为碳源,金属钠为还原剂,在470℃、80Mpa下合成出金刚石,具有深远意义。下列说法不正确的是( )
A.由二氧化碳合成金刚石是化学变化 B.金刚石是碳的一种同位素
C.钠在空气中最终能生成碳酸钠 D.金刚石中只含有非极性共价键
4.漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 = 4ClO2↑+ H+ + Cl- + 2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因可能是( )
A.在酸性条件下亚氯酸的氧化性增强 B.亚氯酸钠比亚氯酸稳定
C.ClO2逸出,使反应物的浓度降低 D.溶液中的Cl-起催化作用
5.下列离子方程式书写正确的是( )
A.苯酚钠溶液中通入CO2气体:2C6H5ONa + CO2 + H2O === 2C6H5OH↓ + Na2CO3
B.实验室用稀硝酸和Zn反应:Zn + 2H+ === Zn2+ + H2↑
C.Na2SiO3溶液中滴加醋酸溶液变浑浊: SiO32-+2CH3COOH=== H2SiO3↓ + 2CH3COO
D.Na2S溶液呈碱性:S2- + 2H2O === H2S + 2OH-
6.将用于2008年北京奥运会的国家游泳中心(水立方)采用了高分子膜材料“ETFE”,该材料是四氟乙烯(CF2=CF2)与乙烯(CH2=CH2)发生聚合反应得到的高分子材料。下列说法不正确的是( )
A.“ETFE”分子中可能存在“—CH2—CH2—CF2—CF2”的连接方法
B.合成“ETFE”的反应为加聚反应
C.CF2=CF2和CH2=CH2均是平面型分子
D.CF2=CF2可由CH3CH3与F2两种物质直接反应制得
7.“长征三号甲”运载火箭将我国自行研制的“嫦娥一号”卫星于2007年10月24日成功发射,标志着我国探月工程一期目标实现。发射火箭用的燃料一部分是液态肼(N2H4)和过氧化氢。已知16g液态肼和过氧化氢反应生成两种无毒气体时,放出a kJ热量。下列热化学方程式正确的是( )
A.N2H4(l) + 2H2O2(l) === N2(g) + 4H2O(g); △H=-2akJ·mol-1
B.N2H4(l) + 2H2O2(l) === N2(g) + 4H2O(g); △H=- akJ·mol-1
C.N2H4(l) + 2H2O2(l) === N2(g) + 4H2O(g); △H=2akJ·mol-1
D.N2H4(l) + H2O2(l) === N2(g) + 2H2O(g);△H=akJ·mol-1
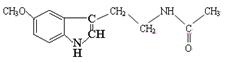 8.脑白金又名褪黑激素,据报道它具有提高免疫力,促进睡眠等功能。其结构简式为:下列有关脑白金说法不正确的是( )
8.脑白金又名褪黑激素,据报道它具有提高免疫力,促进睡眠等功能。其结构简式为:下列有关脑白金说法不正确的是( )
A.能发生加成反应 B.属于芳香族化合物
C.分子式为C13H16N2O2 D.不能使酸性高锰酸钾溶液褪色
二、选择题(每题只有1~2个选项符合题意。每题4分,共24分)
9.在给定条件下,下列加点的物质在化学反应中能被完全消耗的是( )
A.100mL4mol·L-1盐酸与8.7g二氧化锰共热制取Cl2
B.标准状况下,将1g铝片投入20mL18.4mol·L-1H2SO4溶液
C.200mL5mol·L-1的硝酸溶液中加入2.4g镁粉
D.在5×107Pa、500℃和铁触媒催化的条件下,用氮气和氢气合成氨
10.以两块质量相同的铜板为电极,电解足量的AgNO3溶液,一段时间后,溶液质量减少了7.6g,则下列说法中正确的是( )
A.电解过程共转移了0.05mol电子 B.阳极质量减少,阴极质量增加
C.两电极的质量差为14g D.两电极的质量差为7.6g
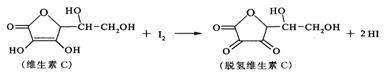 11.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为( )
11.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式为( )
下列说法正确的是 ( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶 D.脱氢维生素C的分子式为C6H6O6
12.把SO2通入Fe(NO3)3溶液中,溶液由棕色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。在上述一系列变化过程中,最终被还原的是( )
A.SO2 B.Cl - C.Fe3+ D.NO3 -
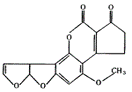 13.黄曲霉素AFTB(右图所示)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,有引发肝癌的可能性,关于黄曲霉素的说法正确的是( )
13.黄曲霉素AFTB(右图所示)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,有引发肝癌的可能性,关于黄曲霉素的说法正确的是( )
A.该化合物的分子式为C16H12O6
B.该化合物水解可生成醇类化合物
C.跟1 mol该化合物反应的H2和NaOH的最大值分别是6 mol和2 mol
D.该化合物所有原子可能在同一平面上
14.实验室将I2 溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:
I2(aq)+I-(aq)![]() I3-(aq)。上述平衡体系中,I3- 的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是( )
I3-(aq)。上述平衡体系中,I3- 的物质的量浓度c(I3-)与温度T的关系如右图所示(曲线上的任何一点都表示平衡状态)。下列说法不正确的是( )
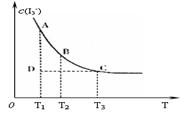 A.该反应的正反应是吸热反应
A.该反应的正反应是吸热反应
B.A点与C点的化学反应速率:vA<vC
C.在反应进行到D点时,v正>v逆
D.A点与B点相比,B点的c(I2)大
三、
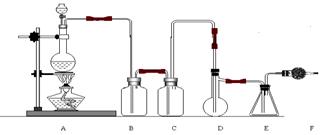 15.(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。 试回答下列问题:
15.(10分)二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。 试回答下列问题:
(1)装置A中发生反应的化学方程式为:
(2)装置C盛放的药品是
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,这样做的目的是
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。
(5)F装置中干燥管内所盛物质的作用是:
16.(10分)KMnO4溶液常用做氧化还原反应滴定的标准液,由于KMnO4的强氧化性,它的溶液易被空气中或水中某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此精确配制KMnO4标准溶液的操作是:
(1)称取稍多于所需量的KMnO4固体溶于水,将溶液加热并保持微沸l h;
(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;
(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处:
(4)利用氧化还原滴定方法,在70℃-80℃条件下用基准试剂(纯度高、稳定性好的物质)溶液测定其浓度。
回答下列问题:
(1)为什么要称取稍多于所需的KMnO4固体?___________________________
(2)为什么不用普通滤纸过滤器过滤?__________________________________
(3)如何保证在70℃~80℃条件下进行滴定操作:_______________________
(4)下列物质中,可以用于测定KMnO4溶液浓度的基准试剂是_____________
A.H2C2O4·2H2O B.FeSO4·7H2O C.浓盐酸 D.Na2SO3
(5)若准确称取W g草酸晶体(H2C2O4·2H2O)溶于水配成500 mL水溶液,取25.00 mL置于锥形瓶中,用高锰酸钾溶液滴定至终点,消耗高锰酸钾溶液V mL。
6H++2MnO4-+5H2C2O4·2H2O====2Mn2++10CO2↑+18H2O,问:
①滴定时,高锰酸钾溶液应装在_____ ___________;
②滴定终点标志是_____________ _____;
③KMnO4溶液的物质的量浓度为____ ______________:
④若滴定前平视,滴定后俯视,则测得的浓度值将_____ ___(填“偏高”或偏低)
四、
17.(10分)如下图,已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为单质。下图中部分反应产物已略去。
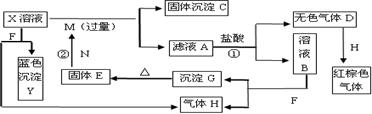 |
⑴红棕色气体及X的化学式分别为 、 。
⑵反应①的离子方程式为_______________________________________________。
反应②的化学方程式为_______________________________________________。
18.(8分)一定条件下,在体积为3 L的密闭容器中, 一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g)。根据题意完成下列各题:
CH3OH(g)。根据题意完成下列各题:
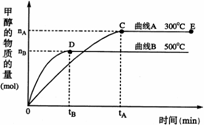 (1)反应达到平衡时,平衡常数表达式K= ,
(1)反应达到平衡时,平衡常数表达式K= ,
升高温度,K值 (填“增大”、“减小”或“不变”);
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)= ;
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是 (填字母序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
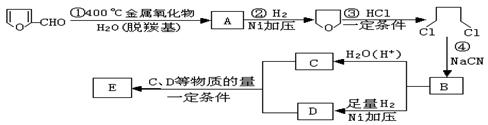
19.(10分)已知:HCN的结构为H—C≡N;
①R—CN RCOOH,
![]() ②R—Cl+CN-
R—CN+Cl-(R为烃基)。
②R—Cl+CN-
R—CN+Cl-(R为烃基)。
![]() 玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
玉米芯、甘蔗渣等废物水解发酵后可制得糠醛
,它是重要的化工原料,它在一定条件下可发生以下变化:
20.(12分)将3.2gCu溶于amol·L-1过量的硝酸30mL中,假设硝酸的还原产物只有NO2和NO,反应结束后,将所得溶液加水稀释至1000mL,测得c(NO3-)为0.2mol·L-1。求:
(1)稀释后溶液中氢离子的物质的量浓度为 。
(2)生成的气体中NO2的物质的量为 ,NO的物质的量为 (用含a的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH=NaNO3+NaNO2+H2O; NO2+NO+2NaOH=2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为 。
(4)氮的氧化物与氨气在一定条件下可以反应生成N2和H2O。若NO2与NO的混合气体平均组成可以表示为NOx,1体积NH3与![]() 体积的NOx刚好完全反应,则x值为
。
体积的NOx刚好完全反应,则x值为
。
六、选做题
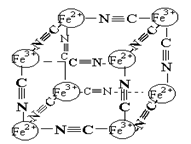 21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )
21A.(1)(2分)分析化学中常用X射线研究晶体结构.有一种蓝色晶体{可表示为:MxFey(CN)Z
},研究表明它的结构特性是:Fe2+和Fe3+分别占据立方体的点, 自身互不相邻,而CN-位于立方体的棱上.其晶体中的部分离子的空间结构关系如图示,下列说法正确的是( )
A.该晶体属于原子晶体
B.该晶体化学式MFe2(CN)6
C.M的离子位于上述立方体的体心,呈+1价
D.该晶体属于离子晶体,M呈+2价
(2)(10分)C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
1) Ge的原子核外电子排布式为
2) C、Si、Sn三种元素的单质中,能够形成金属晶体的是
3) 按要求指出下列氧化物的空间构型、成键方式或性质
①CO2分子的空间构型及碳氧之间的成键方式 ;
②SiO2晶体的空间构型及硅氧之间的成键方式 ;
③已知SnO2是离子晶体,写出其主要物理性质 (写出2条即可)
4) CO可以和很多金属形成配合物,如Ni(CO)4,Ni与CO之间的键型为
5) 碳氧键的红外伸缩振动频率与键的强度成正比,已知Ni(CO)4中碳氧键的伸缩振动频率为2060cm-1,CO分子中碳氧键的伸缩振动频率为2143cm-1,则Ni(CO)4中碳氧键的强度比CO分子中碳氧键的强度 (填字母)
A、强 B、弱 C、相等 D、无法判断
21B.(12分)某化学研究性学习小组探讨Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验。
(1)提出猜想:
甲同学认为发生双水解反应:Fe3++ SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3
乙同学认为发生氧化还原反应,其反应方程式为
(2)实验验证:丙同学设计了下列实验来探究反应的可能性。
①为了检验所用的Na2SO3是否变质,应选用的试剂是
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变为血红色
(3)得出结论:
①根据丙同学的实验得出的结论是:
②实验③中溶液变成血红色的离子方程式为
(4)拓展探究:
丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体。从形式上看,Na2CO3 和Na2SO3相似,但二者的水溶液与氯化铁溶液反应的现象差别很大,其原因是
08届高三第一学期期末模拟考试
化 学 试 题(2)答题纸
姓名 得分
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
| 答案 |
|
|
|
|
|
|
|
|
15.(10分)
(1)
(2) (3)
(4)
(5) 。
(以上每空2分,共10分)
16、(l 0分)
(1) (1分)
(2) (1分)
(3) (1分) (4) (1分)
(5) (2分), (1分)
(2分) (1分)
17.(10分)
⑴ 、
⑵① ②
18.(8分)
(1)
(3分) (1分)
(2)
(2分) (3)
(2分)
19.(10分)
⑴ (各1分,共2分)
⑵ (2分)
(2分)
⑶ (2分)
⑷ (2分)
20.(12分)
(1) (2分)
(2) (2分) (2分)
(3) (3分)
(4) (3分)
21、A
(1)
(2)1) 2)
3)①
②
③
4) 5)
21.B
(1)
(2)
(3) ,
(4)
08届高三第一学期期末模拟考试
化 学 试 题(2)参考答案
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | D | B | D | C | D | A | D |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
| 答案 | C | BC | BD | D | C | A |
|
|
15.(10分)
(1)MnO2 +4HCl(浓) ![]() MnO2 +Cl2↑+2H2O
MnO2 +Cl2↑+2H2O
(2)浓硫酸 (3)增大反应接触面
(4)水浴加热
(5)防止空气中水蒸气进入并吸收残留余的氯气。
(以上每空2分,共10分)
16、(l 0分)(1)有部分KMnO4被还原成MnO(OH)2 (1分)
(2)KMnO4的强氧化性能氧化滤纸(1分)
(3)可在水浴中加热(1分) (4)A (1分)
(5)酸式滴定管(2分),当最后滴下1滴KMnO4溶液后半分钟不褪色时(1分) 10w/63V (2分)偏高 (1分)
17. (10分)⑴NO2、![]()
⑵① 3Fe2+ + NO3-+ 4H+ == 3Fe3+ + NO↑+ 2H2O ② ![]()
18.(8分) (1)K=c(CH3OH)/c(CO)·c2(H2) (3分) 减小 (1分)
(2)2nB/3tBmol·(L·min)-1 (2分) (3) b、c (2分
19.(10分)⑴加成反应 取代反应(各1分,共2分)
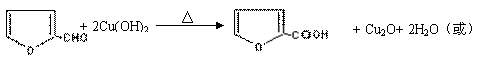 ⑵
⑵ (2分)
(2分)

![]()
![]()
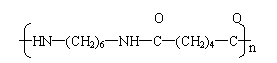 ⑶
(2分)
⑶
(2分)
⑷ (2分)
20.(12分)
(1)0.1mol·L-1(2分,无单位只给1分)
(2)(0045a-0.35)mol(2分,无单位只给1分)
(0.15-0.015a)mol(2分,无单位只给1分)
(3)8.3≤a<10(3分)(8.3<a<10得2分)
(4)1.75(3分)
21、(1)B
1)1s22s22p63s23p63d104s24p2 2)Sn
3)①直线型 共价键(或σ键与π键)
②Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构 共价键(或σ键)
③熔融时能导电、较高的熔点
4)配位键 5)B
21.B(1)Fe3++ SO32-+6H2O= Fe2++ SO42+2H+
(2)BaCl2 和稀盐酸
(3)两个反应同时发生,
Fe(OH)3(胶体)+ SCN-= Fe(SCN)3+3OH-
(4) SO32- 水解能力较CO32-小,且SO32-具有还原性