08届高三化学第一学期期末考试试卷
考生注意:
1、本试卷分为第Ⅰ卷(1-22题)和第Ⅱ卷(23-31题)两部分。满分150分,考试时间120分钟。
2、第Ⅱ卷不设分叉题。
3、本试卷采用答题卷,所有答案都写在答题卷上。请考生在答题卷上准确填写学校、姓名、班级、学号等信息。
相对原子质量:Ba-137,Cl-35.5,K-39,C-12,O-16,H-1,Fe-56,Cu-64
第Ⅰ卷(共66分)
一、选择题(本题共10分),每小题2分,只有一个正确选项。
1.近年来,在许多城市街头发现不少公交车和出租车上印有“CNG”的标志,表示它们是以天然气作燃料的汽车。请回答:城市推行这一改革的主要目的是…………( )
A.延长发动机的寿命 B.促进地方经济的发展,增加再就业机会
C.节约能源 D.减少大气污染
 2.“能源分类相关图”如右图所示,下列四组选项中,全部符合图中阴影部分的能源是…………………………………( )
2.“能源分类相关图”如右图所示,下列四组选项中,全部符合图中阴影部分的能源是…………………………………( )
A.煤炭、沼气、核能
B.水能、生物能、天然气
C.太阳能、风能、潮汐能
D.地热能、海洋能、石油
3.用NA表示阿伏加德罗常数的值, 下列说法正确的是……………………………( )
A.将分子总数共NA个的NO2和N2O4混合气体,降温至标准状况,其体积为22.4L
B.1L 1 mol/L的氯化铁溶液中含有铁离子的数目为NA
C.含0.10mol溶质的稀硫酸在化学反应中最多可提供的H + 数为0.1NA
D.标准状况下22.4L甲烷含有的电子数约为10 NA
4.澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性。纳米泡沫碳与金刚石的关系是( )
A.同系物 B.同分异构体 C.同位素 D.同素异形体
5.1869年,由俄国化学家门捷列夫编制出第一张化学元素周期表,最大贡献是发现元素周期律。1955年,化学界为纪念门捷列夫发现元素周期律,将101号元素命名为( )
A.铪 B.钌 C.钔 D.钽
二、选择题(本题共36分),每小题3分,只有一个正确选项。
6.下列各组物质,固态时属于同类型晶体的一组是…………………………………( )
A.NH3、NH4Cl B.Si、SiO2 C.Al、Al2O3 D.NaCl、HCl
7.能实现Al3+ + 3AlO2– + 6H2O → 4Al(OH)3↓过程的是…………………………( )
A.向铝盐溶液中不断滴加NaOH溶液 B.向偏铝酸盐溶液中不断加入盐酸
C.向NaAlO2溶液中不断通入CO2气体 D.向NaOH溶液中不断滴加铝盐溶液
8.下列各组离子在水溶液中能大量共存的是…………………………………………( )
A.Na+、HS–、Cu2+、Cl– B.HS–、Na+、OH–、K+
C.K+、CO32–、Br–、AlO2– D.H+、Cl–、Na+、SO32–
9.已知下列元素的原子半径为:
| 原子 | N | S | O | Si |
| 半径r / 10_10m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是………………………………………………( )
A.0.80×10_10m B.1.10×10_10m
C.1.20×10_10m D.0.70×10_10m
10.实验室测定硫酸铜晶体结晶水含量的实验中,下列操作对实验结果无影响的是( )
A.将硫酸铜晶体加热到完全失去结晶水,然后放在空气中冷却
B.硫酸铜晶体中含有加热不分解的物质
C.瓷坩埚外表面附着加热不分解的物质
D.加热时温度过高,晶体变成灰白色
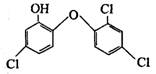 11.英国媒体2005年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳 (三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如右,则下列有关说法错误的是…………………( )
11.英国媒体2005年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳 (三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如右,则下列有关说法错误的是…………………( )
A.三氯生的分子式为:C12H7C13O2
B.三氯生能与氢氧化钠溶液反应
C.三氯生易溶于水
D.哥罗芳不存在同分异构体
![]()
![]() 12.为解决污染和能源上的重大问题,有些化学家提出一些化学反应的步骤,如:( )
12.为解决污染和能源上的重大问题,有些化学家提出一些化学反应的步骤,如:( )
![]()
![]() ①CaBr2 + H2O CaO+2HBr ②2HBr+ Hg
HgBr2+ H2
①CaBr2 + H2O CaO+2HBr ②2HBr+ Hg
HgBr2+ H2
③HgBr2+ CaO HgO + CaBr2 ④HgO Hg +1/2O2
但这些设想如何进一步操作尚未解决。这种联合反应的目的是为了制备
A.HBr B.H2 C.O2 D.Hg
13.短周期元素的离子M2+和N2―具有相同的电子层结构,则下列说法正确的是…( )
A.M2+的离子半径比N2―小 B.M的原子序数比N小
C.M和N原子的电子层数相等 D.M和N原子最外层电子数相等
14.FeS2的结构类似于Na2O2,是一种过硫化物,与酸反应时生成H2S2,H2S2类似H2O2易分解。实验室用稀盐酸与FeS2颗粒混合,则反应完毕后不可能生成的物质是……………………………………………………………………………( )
A.H2S B.S C.FeS D. FeCl2
15.下列离子方程式中书写正确的是…………………………………………………( )
![]() A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3―+OH― CO32―+H2O
A.碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3―+OH― CO32―+H2O
![]() B.氯化铁溶液中通入硫化氢气体:2Fe3++S2― 2Fe2++S↓
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2― 2Fe2++S↓
![]() C.次氯酸钙溶液中通入过量CO2:Ca2++2ClO―+H2O+CO2 CaCO3↓+2HClO
C.次氯酸钙溶液中通入过量CO2:Ca2++2ClO―+H2O+CO2 CaCO3↓+2HClO
![]() D.溴化亚铁中加入少量氯水:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
D.溴化亚铁中加入少量氯水:2Fe2+ + Cl2 2Fe3+
+ 2Cl-
16.在下列叙述中,不能说明盐酸是强酸,醋酸是弱酸的是………………………( )
A.将pH=4的盐酸和醋酸都稀释成pH=5的溶液,醋酸所需加入的水量多
B.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变化大
C.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
D.相同物质的量浓度的盐酸和醋酸,盐酸的pH小于醋酸
17.燃烧含甲烷、乙烯、丙炔的混合气体6升,生成10升二氧化碳和一定量的液态水(气体均在相同状况下),则原混合气体中甲烷、乙烯、丙炔的体积比为…………( )
A.3∶2∶1 B.1∶3∶2 C.1∶2∶3 D.2∶1∶3
三、选择题(本题共20分),每小题4分,有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
![]() 18.在容积不变的密闭容器中的如下反应:2SO2(g)+O2(g) 2SO3(g)+196.6kJ·mol-1,
18.在容积不变的密闭容器中的如下反应:2SO2(g)+O2(g) 2SO3(g)+196.6kJ·mol-1,
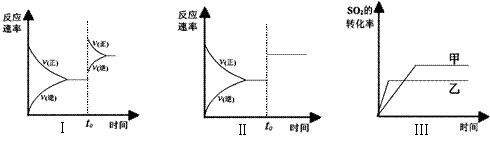 当其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是……( )
当其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是……( )
A.图I研究的是t0时刻增大O2的浓度对反应速率的影响
B.图II研究的是t0时刻加入催化剂后对反应速率的影响
C.图III研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图III研究的是温度对化学平衡的影响,且乙的温度较低
19.在100mL0.10mol/L的AgNO3溶液中加入100mL溶有2.08g BaCl2的溶液,再加入100mL溶有0.010molCuSO4·5H2O的溶液,充分反应。下列说法中正确的是…………( )
A.最终得到白色沉淀和无色溶液
B.最终得到白色沉淀是等物质的量的两种化合物的混合物
 C.在最终的溶液中n(Cl―)=0.01mol
C.在最终的溶液中n(Cl―)=0.01mol
D.在最终的溶液中c(Cu2+)=0.01mol/L
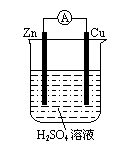
20.关于右图所示装置的下列说法中正确的是…………………( )
A.电流表指针不会偏转
B.Zn是阴极,Cu是阳极
C.外电路中电流方向是Cu→Zn
D.Zn是负极,在反应中失去电子,发生氧化反应
21.向300mLKOH溶液中缓慢通入2.24L(标准状况) CO2气体,充分
反应后,在减压低温下蒸发溶液,得到19.4g白色固体。则下列
说法中正确的是…………………………………………………………………( )
A.此白色固体是KOH和K2CO3的混合物
B.此白色固体是K2CO3和KHCO3的混合物
C.原KOH溶液的物质的量浓度是1 mol/L
D.原KOH溶液的物质的量浓度是0.5 mol/L
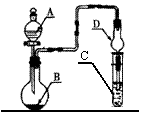 22.按右图装置(夹持仪器略)进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是………………………………………………( )
22.按右图装置(夹持仪器略)进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是………………………………………………( )
A.若A为浓盐酸,B为MnO2,C中盛品红溶液,
则C中溶液褪色
B.若A为醋酸,B为贝壳,C中盛澄清石灰水,
则C中溶液变浑浊
C.若A为浓氨水,B为生石灰,C中盛A1C13溶液,
则C中先产生白色沉淀后沉淀又溶解
D.实验仪器D可以起到防止溶液倒吸的作用
第Ⅱ卷(共84分)
四、(本题共24分)
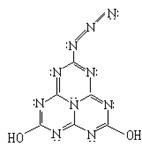 23.(8分)2001年是20世纪伟大的化学家鲍林(Linus Pauling 1901~1994)诞辰100周年。他是一位化学结构大师,曾获得1954年诺贝尔化学奖。后人在他的遗作中发现有一结构式如右图所示。
23.(8分)2001年是20世纪伟大的化学家鲍林(Linus Pauling 1901~1994)诞辰100周年。他是一位化学结构大师,曾获得1954年诺贝尔化学奖。后人在他的遗作中发现有一结构式如右图所示。
请你对这个结构作一番分析后,回答下列问题。
(1)它的分子式是 。
(2)如果该分子中的氮原子都在一个平面上,则该分子中的所有原子是否可能处于同一平面内 (填“可能”或“不可能”)。
(3)有人预测它可能是炸药,如果它在没有氧气参与的情况下发生爆炸(假设发生分解反应,生成两种单质和两种氧化物,其中一种是CO气体),则反应的化学方程式可能为 ;如果有足量氧气参与的条件下发生爆炸,反应方程式为 ,1mol该化合物爆炸时需消耗 mol氧气。
![]() 24.(8分)t℃时,将3 mol A和1 mol B气体通入容积为2 L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) xC(g)+Q(Q>0),2 min时反应达到平衡状态(温度不变),剩余了0.8
mol B,并测得C的浓度为0.2mol/L,请填写下列空白:
24.(8分)t℃时,将3 mol A和1 mol B气体通入容积为2 L的密闭容器中(容积不变),发生如下反应:3A(g) + B(g) xC(g)+Q(Q>0),2 min时反应达到平衡状态(温度不变),剩余了0.8
mol B,并测得C的浓度为0.2mol/L,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为 mol/L·min。
(2)x= ;此反应的平衡常数表达式K= 。
(3)恒温时,若向上述平衡混合物的容器中再充入a mol C后,化学平衡将向 方向移动,B物质的质量分数 ,K值 (填“变大”或“变小”或“不变”,下同)。
(4)若升高反应体系的温度,v (C) ,混合气体的平均相对分子质量 。
25.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B、D分别是同一主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。
(1)D元素在周期表中的位置 ,其原子的核外电子排布式 。
(2)C、D两元素形成的化合物W的电子式为 ,其水溶液呈 性。
(3)A、C、D三种元素共同构成的化合物中含有的化学键为 、 。
(4)写出两种均含A、B、C、D四种元素的化合物相互间发生反应,且生成气体的离子方程式 。
五、(本题共24分)
26.(10分)下图是一个制取氯气,并以氯气为原料进行特定反应的装置。
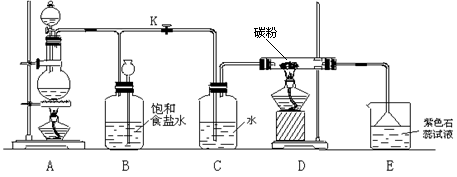
(1)A是氯气发生装置,其反应的化学方程式为 。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,将Cl2充满整个装置,再点燃D处的酒精灯,接上E装置,Cl2通过C瓶后再进入D,发生反应后的产物是CO2和HCl,试写出D中的反应化学方程式 。装置C的作用是 。
(3)在E处,可能观察到的实验现象是 。
(4)若将E处烧杯中的溶液改为澄清的石灰水,反应过程中现象为 (填字母编号)
A.有白色沉淀生成 B.无明显现象 C.先有白色沉淀生成后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,B的作用是
。
![]() 27.(14分)某种碱式碳酸铜,其组成可表示为:Cu2(OH)2CO3·xH2O。在加热条件下,可以发生分解,化学方程式为:Cu2(OH)2CO3·xH2O
2CuO+CO2↑+(x+1) H2O
27.(14分)某种碱式碳酸铜,其组成可表示为:Cu2(OH)2CO3·xH2O。在加热条件下,可以发生分解,化学方程式为:Cu2(OH)2CO3·xH2O
2CuO+CO2↑+(x+1) H2O
现取一定量的(不称量其质量)该固体样品,先后完成两个实验:
实验(i):测定该碱式碳酸铜粉末的组成中结晶水x的值;
实验(ii):用实验(i)结束后的残留固体完成乙醇的催化氧化并验证其反应产物。
请回答下列问题:
(1)用下图中的仪器(必要的铁架台、铁夹、酒精灯等均在图中略去)组装完成实验(i)的实验装置,组装时仪器按气流方向从左到右连接的顺序为 → → → C 。
在这套装置中,干燥管C中盛有的物质是 。(填写下列选项的编号)
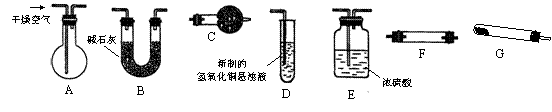 A.无水硫酸铜 B.碱石灰 C.氯化钠晶体 D.无水氯化钙
A.无水硫酸铜 B.碱石灰 C.氯化钠晶体 D.无水氯化钙
(2)若要用上图中的各种仪器组装完成实验(ii)的实验装置,组装时仪器也按气流方向从左到右连接的顺序为 → → → 。在这套装置中,干燥管C的作用是 。
(3)在完成两个实验时,首先都必须先 (实验操作步骤),然后在仪器 (填装置对应字母,下同)中加入碱式碳酸铜,乙醇放入仪器 中。
(4)在实验(ii)中,需要加热的仪器是 (填装置对应字母)。
(5)写出D中反应的化学方程式为
(6)若实验(i)测得CO2的质量为a克,水的质量为b克,则x的表达式= 。
 六、(本题共20分)
六、(本题共20分)
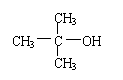
28.(10分)已知 不能氧化为醛或羧酸。PMAA是一种“智能型”大分
子,可应用于生物制药中大分子和小分子的分离。下列是以A物质为原料合成PMAA的路线:
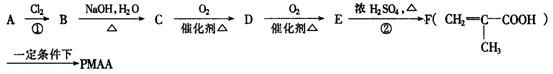 (1)分别写出A和PMAA的结构简式:A
;
(1)分别写出A和PMAA的结构简式:A
;
PMAA 。
(2)上述反应过程中①②的反应类型分别是① ; ② 。
(3)写出E→F的化学方程式 。
![]() 29.(10分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成
29.(10分)1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成
方法是:RX+Mg RMgX(Grignard试剂),生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
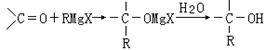
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路图如下。其中,H具有对称结构且其一氯代物只有3种。
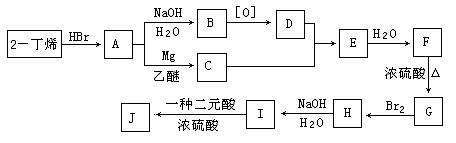
请按要求填空:
(1)D的结构简式为 、F的结构简式 ;
(2)C+D→E的反应类型是 ,H→I的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,
试写出此高聚物的结构简式 。
七、(本题共16分)
30.(6分)国家规定FeCl3·6H2O二级品中FeCl3·6H2O质量分数不低于99%;三级品中FeCl3·6H2O质量分数不低于98%。现称取样品0.500g,用适量蒸馏水充分溶解后,向其中加少量盐酸酸化,再加过量的KI溶液使其充分反应。最后用0.100mol/L的标准Na2S2O3溶液滴定,滴定到终点时用去18.17mL标准溶液。
相关的化学方程式:2Fe3++2I–→2Fe2++I2,2Na2S2O3+I2→Na2S4O6+2NaI。请回答:
(1)滴定中所用指示剂是 ,
到达终点时的现象是 。
(2)通过计算说明此样品属于哪一级产品?
31.(10分)将3.20g Cu溶于a mol/L过量的硝酸溶液30.0mL中,假设硝酸的还原产物只有NO2和NO,反应结束后将所剩余溶液加水稀释至1000mL,测得c(NO3–)为0.200mol/L。求:
(1) 稀释后溶液的pH。
(2) 生成的气体中NO2的物质的量和NO的物质的量(用含“a”的关系式表示)。
(3) 用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
2NO2+2NaOH→NaNO3+NaNO2+H2O,NO2+NO+2NaOH→2NaNO2+H2O
若生成的混合气体能被NaOH溶液完全吸收,试讨论a的取值范围。
 高三期末考试
高三期末考试
化 学 答 案
| 题 号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
| 应得分 | 10 | 36 | 20 | 24 | 24 | 20 | 16 | 150 |
| 实得分 |
一、选择题(单选题,每个2分,共10分)
| 题序 | 1 | 2 | 3 | 4 | 5 |
| 答案 | D | C | D | D | C |
二、选择题(单选题,每个3分,共36分)
| 题序 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 |
| 答案 | B | D | C | B | C | C | B | A | C | D | C | A |
三、选择题(每小题有1-2个正确选项,每个4分,共20分)
| 题序 | 18 | 19 | 20 | 21 | 22 |
| 答案 | B | B C | C D | A C | B D |
四、本题共24分
23.(1)C6H2N10O2 (2分)(2)可能 (1分)(3)C6H2N10O2→5N2↑+5C+CO↑+H2O(2分)、
2C6H2N10O2+11O2→12CO2↑+2H2O+10N2↑ (2分)、 5.5 (1分)。
24.(1) 0.1 (1分)(2) 2 (1分)、 [C]2/[A]3·[B] (1分);
(3) 逆反应 、 变大 、 不变 (4) 变大 、 变小 。(5×1分)
![]()
![]()
 25.(1)
第三周期VIA (1分), 1s22s22p63s23p4
(1分)。
25.(1)
第三周期VIA (1分), 1s22s22p63s23p4
(1分)。
(2)Na+[ S ]2-Na+、 碱性 ;(2×1分)(3) 离子键 、 共价键;(2×1分)
(4) HSO3-+H+ → SO2↑+H2O 。(2分)
五、(本题共24分)
![]() 26.(1) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O ;(2分)
26.(1) MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O ;(2分)
![]() (2)
2Cl2+C+2H2O CO2+4HCl (2分)、吸收Cl2中的HCl气体,提供D处
(2)
2Cl2+C+2H2O CO2+4HCl (2分)、吸收Cl2中的HCl气体,提供D处
所需的水蒸气 (1分) ;
(3) 紫色石蕊试液由紫色变为红色,再变为无色 ;(1分)(4) B ;(1分)
(5) 长颈漏斗内液面上升 (1分)
防止Cl2逸出污染环境,避免装置内压强过大造成危险 。(1分)
27.(1) G → E → B → C (2分)、 B、D ;(1分)
(2) A → F → C → D (2分)、 检验反应中生成的水 ;(1分)
(3) 检验装置的气密性 、 F 、 A ;(1+1+1分)(4) A 、D、 F ;(2分)
![]() (5) CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O ;(2分)
(5) CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O ;(2分)
(6) (22b-9a)/9a 。(2分)
|
|
|

![]() (2)反应类型① 加成反应 、② 消去反应 。
(1+1分)
(2)反应类型① 加成反应 、② 消去反应 。
(1+1分)
|
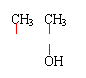
![]() 29.(1)D、 CH3—CH2—C—CH3 F: CH3—CH2—CH—C—CH2—CH3
; (2+2分)
29.(1)D、 CH3—CH2—C—CH3 F: CH3—CH2—CH—C—CH2—CH3
; (2+2分)
(2)C+D→E的反应类型是 加成反应 ,H→I的反应类型是 取代反应 ;(1+1分)
![]()
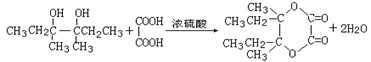 (3)A→B CH3CH2CH(Br)CH3+NaOH
CH3CH2CH(OH)CH3+NaBr ;(2分)
(3)A→B CH3CH2CH(Br)CH3+NaOH
CH3CH2CH(OH)CH3+NaBr ;(2分)
I→J (2分)。
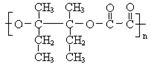 (4)
(2分)
(4)
(2分)
七、计算题(本题共16分)
30.(1) 淀粉溶液 、 蓝色恰好消失,且在半分钟内不变色 。(1+1分)
(2)解:
![]()
(1分)
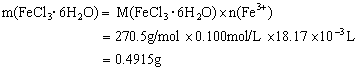
(1分)
FeCl3·6H2O%=0.4915÷0.500×100%=98.3%>98% (1分)
∴属于三级品 (1分)
31.(1)解:n(Cu)=![]() =0.05mol c(Cu2+)=0.05mol·L-1
(2分)
=0.05mol c(Cu2+)=0.05mol·L-1
(2分)
根据电荷守恒:c(NO3―)=2c(Cu2+)+c(H+)
c(H+)=c(NO3―)-2c(Cu2+)=0.200mol·L-1-2×0.05mol·L-1=0.1mol·L-1
∴pH=-lg0.1=1 ……………………………………………………(2分)
(2)解:
根据物料守恒:n(NO2)+n(NO)+n(NO3―)=0.03a
根据电子守恒:n(NO2)+3n(NO)=0.05mol×2
n(NO2)=(0.045a-0.350)mol …………………………………………(2分)
n(NO)=(0.150-0.015a)mol …………………………………………(2分)
(3)解:
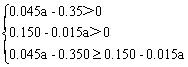
解得:8.3≤a<10 ……………………………………………………(2分)