08届高三化学第一学期第一次适应性测试
高三年级化学试卷
满分:108分 考试时间: 90分钟 命题人:朱成明 校对人:王芳琴
可能用到的相对原子质量:H:1 C:12 O:16 S:32 Cl:35.5 Fe:56 Cu:64
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.“保护环境,就是保护自己”。目前在我国城市环境中主要的大气污染物是
A.SO2、NO2、CO、烟尘 B.CO2、Cl2、N2、酸雨
C.HCl、SO2、N2、粉尘 D.CO2、NO、NH3、雾
2.用特殊方法把固体物质加工到纳米级(1nm~l00nm)的超细粉末粒子,然后得到纳米材料。下列分散系中分散质的微粒直径和这种粒子具有相同数量级的是
A.溶液 B.悬浊液 C.胶体 D.乳浊液
3.你认为减少酸雨的途径可以采取的措施是:①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰石 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
4.下列关于铜电极的叙述 正确的是
A.铜锌原电池中铜作阳极 B.用电解法精炼粗铜时铜作阳极
C.在镀件上电镀铜时用铜作阳极 D.电解稀硫酸制H2、O2可用铜作阳极
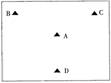
5.A、B、C、D四地的地理位置如右图所示,交通均较为便利,其它的地理条件如下:
|
C地有较为丰富黄铁矿资源 D地有少量的硫酸消费
根据以上信息,在硫酸厂厂址的选择时应选择
A.A地 B.B地 C.C地 D.D地
6.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质(中括号内),溶液能与原来溶液完全一样的是
A.CuCl2 [CuSO4] B.NaOH [NaOH] C.NaCl [HCl] D.CuSO4 [Cu(OH)2]
7.向氢氧化铁胶体中逐滴加入一种液体,首先使溶胶发生凝聚而沉淀,继续加入使沉淀消失,这种液体是
A.0.5mol/L盐酸 B.0.5mol/L硫酸镁溶液
C.0.5mol/L氯化钾溶液 D.没有这种液体
8.泽维尔研究发现,当激光脉冲照射NaI时,Na+和I-两核间距10至15Å,呈离子键;当两核靠近约距2.8Å时,呈现共价键。根据泽维尔的研究成果你能得出的结论是
A.NaI晶体是离子晶体和分子晶体的混合物 B.在NaI晶体中既有离子键,又有共价键
C.共价键和离子键没有明显的界限 D.离子化合物可能含有共价键,共价化合物可能含有离子健
9.在海洋底部存在大量称为“可燃冰”的物质,其蕴藏量是地球上煤、石油的几百倍,因而是一种等待开发的巨大能源物质。初步查明可燃冰是甲烷、乙烷等可燃性气体的水合物。有关可燃冰的下列推测中不正确的是
A.高压、低温有助于可燃冰的形成 B.可燃冰的微粒间可能存在一种比范德华力更强的相互作用力
C.常温、常压下可燃冰是一种稳定的物质 D.构成可燃冰的原子间存在极性共价键
10.下列热化学方程式中的ΔH能表示物质燃烧热的是
A. 2 CO(g) + O2(g) = 2 CO2(g) ΔH = - 566 KJ·mol-1
B. CH4(g) + 2 O2(g) = CO2(g) + 2 H2O(l) ΔH = - 890 KJ·mol-1
C. 2 H2(g) + O2(g) = 2 H2O(l) ΔH = - 571.6 KJ·mol-1
D. H2(g) + Cl2(g) = 2 HCl(g) ΔH = - 184.6 KJ·mol-1
11.1993年世界10大科技新闻称,中国科学家徐志傅和美国科学家共同合成了世界上最大的碳氢化合物,其中1个分子是由1134个碳原子和1146个氢原子构成。关于该物质的下列说法中错误的是
A. 该物质属于烃类 B. 常温下呈固态
C. 具有类似金刚石的硬度 D. 能在空气中燃烧
12.用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等的是
| A | B | C | D | |
| 甲 池 | HCl(aq) | CuCl2(aq) | NaOH(aq) | H2SO4(aq) |
| 乙 池 | NaCl(aq) | K2SO4(aq) | CuSO4(aq) | AgNO3(aq) |
13.如图示,某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
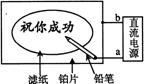 A.铅笔端作阳极,发生还原反应
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生还原反应
C.a点是负极,b点是正极
D.铅笔端有少量的氯气产生
14.已知某装置中发生如下反应:2Cu2++2H2O=2Cu+O2↑+4H+,下列有关该装置的说法错误的是
A.该装置是将电能转化为化学能的电解池 B.该装置是将化学能转化为电能的原电池
C.该装置的电解质溶液可能是可溶性铜盐溶液 D.该装置的阳极一定不是铜电极
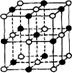 15.最近发现上种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为
15.最近发现上种由钛(Ti)原子和碳原子构成的气态团簇分子,分子模型如图所示,其中圆圈表示钛原子,黑点表示碳原子,则它的化学式为
A.TiC B.Ti4C7 C.Til3C14 D.Til4C13
16.氧化反应和还原反应分别在两个电极上自发进行时,便能构成原电池反应,下列氧 化还原反应,在一定的条件下不能设计成原电池反应的是
A .Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O B. 2Fe+O2+2H2O=2Fe(OH)2
C .Zn+Ag2O+H2O=Zn(OH)2+2Ag D. 2FeCl3+Fe2=3FeCl2
17.参照反应Br + H2 = HBr +H的能量对反应历程的示意图, 下列叙述中正确的是
![]()
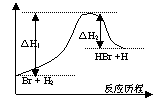 A. 正反应为吸热反应
A. 正反应为吸热反应
B. 加入催化剂,该化学反应的反应热变大
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
18.在盛有饱和Na2CO3溶液的烧杯中,插入惰性电极,保持温度不变,通电一定的时间后,下列判断正确的是
A.溶液的pH将增大 B.溶液中Na+数和CO32-数的比值将变小
C.溶液浓度不变,有晶体析出 D.溶液浓度逐渐增大并有晶体析出
二、填空简答题:(本题包括5小题,共42分)
19.(8分)有四种同族(系列)的物质,它们的沸点(温度/℃,压强为1.01×105Pa)如下表所示:
| 1 | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| 2 | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| 3 | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| 4 | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答下列问题:
(1)写出系列2中物质主要化学性质的递变规律(任写1种)__________________________。
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________________________;
(3)上表中,_________和________(写化学式)两种物质的沸点较同系列其它物质反常,反常的主要原因是____________ 。
20.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B,D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
(1) C、D组成的常见化合物,其水溶液呈碱性,原因是 ______________________。
(用离子方程式表示)。
(2)4.0 g D单质在足量的B单质中完全燃烧,放出37 kJ热量,写出其热化学方程式: 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是 。
21. (8分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度
会自行降低,并析出晶体。导致溶液温度降低的原因可能是 ;
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
22.(6分)近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以直接提供现成形式能量的能源称为一级能源,如煤、石油、太阳能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是________________。
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
H2(g)+![]() O2(g)===H2O(l) ΔH=-285.8
kJ·mol-1 C(g)+O2(g)===CO2(g) ΔH=-393.5
kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8
kJ·mol-1 C(g)+O2(g)===CO2(g) ΔH=-393.5
kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_____________________(列出计算式)。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式______。
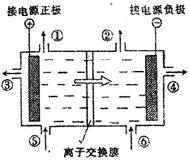 23.(12分)右图是目前世界上比较先进的电解制碱技术—离子交换膜法的示意图。精制饱和食盐水,纯水(含少量NaOH)分别加入上述电解槽中,可以得到气体产物①、②以及NaOH溶液,电解后的淡盐水从电解槽中导出可重新用于配制食盐水。根据上述信息回答下列问题:
23.(12分)右图是目前世界上比较先进的电解制碱技术—离子交换膜法的示意图。精制饱和食盐水,纯水(含少量NaOH)分别加入上述电解槽中,可以得到气体产物①、②以及NaOH溶液,电解后的淡盐水从电解槽中导出可重新用于配制食盐水。根据上述信息回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的方程式 。与电源负极相连的电极负极溶液PH值 (填:不变,升高或降低)。
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a、b、c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂,最后加入盐酸
b.先加NaOH,后加钡试剂,再加Na2CO3,最后加入盐酸
c.先加钡试剂,后加NaOH,再加Na2CO3,最后加入盐酸
(4)溶液中的Na+、H+、Cl_、OH_能通过离子交换膜的是________________。
(5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为_____________________。
三、分析计算题(本题包括2小题,共12分)
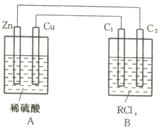 24.(4分)某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,若Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
24.(4分)某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,若Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
25.(8分)某硫酸厂用接触法制硫酸的生产过程中
(1)若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(2)煅烧10t含FeS290.0%的黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
高三年级化学参考答案
一、选择题(本题包括18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1A 2C 3C 4C 5B 6C 7A 8C 9C 10B 11C 12A 13C 14B 15D 16A 17A 18C
二、填空简答题:(本题包括5小题,共42分)
19.(8分)(1)氧化性逐渐减弱(2分) (2)随着相对分子质量增大,沸点逐渐升高(2分)
(3)HF、H2O(2分) 分子之间易形成氢键(2分)
![]() 20.(8分)(1)S2-+
H2O HS-+OH-;(2分)
20.(8分)(1)S2-+
H2O HS-+OH-;(2分)
(2)S(s)+O2(g) =SO2(g);△H =-296.0 kJ/mol (2分)
(3)负极 ;(2分) O2+2H2O+4e-=4OH-(2分)
21(8分) (1)2H2SO3+O2=2H2SO4 2(NH4)2SO3 +O2 =2(NH4)2SO4 2NH4HSO3+O2=2NH4HSO4(任选两个)
(2)析出晶体的反应为吸热反应 (3)BC
22. (6分) (1)C(2分) (2)285.8/2:393.5/12=4.36∶1(2分) (3)PdH0.8 (2分)
解析:(1)光解水法:利用特殊催化剂,模拟生物光合作用制取氢气,是较经济且资源可持续利用的制氢方法。
(2)由热化学方程式可知,相同质量的氢气和碳完全燃烧时放出的热量之比:
(285.8 kJ·mol-1×![]() )∶(393.5 kJ·mol-1×
)∶(393.5 kJ·mol-1×![]() )=4.36∶1
)=4.36∶1
(3)由题意可知,1 cm3钯粉可吸收896 cm3的氢气,
Pd∶H=![]() ∶
∶![]() ×2=1∶0.8 故氢化物的化学式为PdH0.8
×2=1∶0.8 故氢化物的化学式为PdH0.8
23.(12分)(1)2Cl--2e-===Cl2;(2分)升高;(2分)
(2)a、c (2分) (3)b、c(2分) (4)Na+ H+ (2分)
(5)NaCl+H2O=====NaClO+H2↑(通电)
或2NaCl+2H2O=======H2↑+Cl2↑+2NaOH(通电)
Cl2+2NaOH====NaCl+NaClO+H2O(2分)
三、分析计算题(本题包括2小题,共12分)
24.(4分)64 M(RClx)=13.5/0.1=135
由题可知: 2Rx+ ~xH2
2R g x mol
0.032g 0.5*10-3 计算出R=32x ,讨论可求出x=2,R=64符合题意
25. (8分)(1)SO3(g) + H2O⑴ == H2SO4⑴;△H == -130.3 kJ/mol (2分)
(2)3.36 × 106 (2分) 15 (2分) 3.43×107 (2分)
分值分布
晶体类型与性质22分 胶体性质与运用6分 能量变化18分 电化学37分 硫酸工业及环保19分
其它6分