高三化学复习单元测试(6)—氧族元素 环境保护
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 C:12 O:16 S:32 N:14 Cu:64 Fe:56 Ag:108
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题4分,共12题)
1.(2007年高考全国理综卷I)下列有关环境问题的说法正确的是
(A)燃煤时加入适量石灰石,可减少废气中SO2的量
(B)臭氧的体积分数超过10-4%的空气有利于人体健康
(C)pH在5.6~7.0之间的降水通常称为酸雨
(D)含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
2.(2007年高考广东理基,环境保护)污水处理的主要方法有:①中和法;②化学沉淀法;③氧化还原法;④过滤法。其中属于化学方法的有
(A)①②③ (B)①②④ (C)②③④ (D)①②③④
3.(2007年高考海南化学卷,氧族)下列实验现象的描述错误的是
(A)氢气在氯气中燃烧生成绿色烟雾
(B)红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒
(C)点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰
(D)钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体
4.(2007年高考上海化学卷,硫)有关物质燃烧时火焰颜色描述错误的是
(A)氢气在氯气中燃烧 — 苍白色 (B)钠在空气中燃烧 — 黄色
(C)乙醇在空气中燃烧 — 淡蓝色 (D)硫在氧气中燃烧 — 绿色
5.(2007年高考广东理基,硫酸)某溶液中可能含有SO42 -、CO32 -、Cl-。为了检验其中是否含有SO42 -,除BaCl2溶液外,还需要的溶液是
(A)H2SO4 (B)HCl (C)NaOH (D)NaNO3
6.(06广东6)等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是
A.2mol·L-1H2SO4溶 B.18 mol·L-1H2SO4溶液C.6 mol·L-1KOH溶液D.3 mol·L-1HNO3溶液
7. 对下列事实的解释错误的是
A.在蔗糖加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性
B.向50mLl8mol/L的H2SO4溶液中加入足量铜片加热充分后,被还原的H2SO4的物质的量小于0.45mol
C.常温下,浓H2SO4可以用铝制容器贮存,说明铝与浓硫酸不反应
D.反应CuSO4+H2S===CuS+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸
8. 下列关于浓硫酸的叙述正确的是
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
9.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序是SO2>I->H2O2>Fe2+>Cl-,则下列反应不可能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO![]() +4H+ B.2Fe2++Cl2====2Fe3++2Cl-
+4H+ B.2Fe2++Cl2====2Fe3++2Cl-
C.I2+SO2+2H2O====H2SO4+2HI D.H2O2+H2SO4====SO2+O2+2H2O
10. .欲鉴别物质的量浓度都为0.1 mol·L-1的KCl、(NH4)2SO4、NH3·H2O和H2SO4四瓶无色溶液,下列实验方案最佳的是
A.用pH试纸鉴别 B.分别用闻气味和pH试纸鉴别
C.分别用BaCl2和NaOH溶液鉴别 D.用Ba(OH)2溶液鉴别
11. 下列离子方程式书写正确的是:
A.将Ba(OH)2溶液不断加入KAl(SO4)2溶液中反应至沉淀物质的量最大:
3Ba2+ + 6OH– + 2Al3+ + 3SO42–== 3BaSO4↓+ 2Al(OH)3↓
B.向硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O =AgOH↓ + NH4+
C.CuSO4溶液跟Ba(OH)2溶液混合:Ba2+ + SO42– == BaSO4↓
D.氢氧化铁溶于氢碘酸中:Fe(OH)3 + 3H+ = Fe3+ + 3H2O
12. .下列溶液中,不能区别SO2和CO2气体的是
①石灰水 ②KMnO4溶液 ③溴水 ④酸化的Ba(NO3)2溶液 ⑤品红溶液
A.①②③⑤ B.②③④⑤ C.只有① D.①③
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
第Ⅱ卷(非选择题共60分)
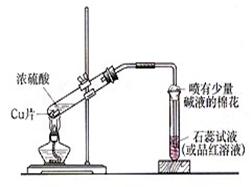 13.(18分)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 _____________
。
13.(18分)实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验。(1)根据什么现象可判断铜跟浓硫酸反应有SO2生成 _____________
。
根据什么现象可判断铜跟浓硫酸反应有硫酸铜生成_____________________________________________________。
写出甲装置中发生的主要反应的化学方程式_____________________________________________________。
(2)你在实验室中进行这个实验时,除了(1)小题中指到的实验现象外,还可以观察到许多其它的实验现象,请写出两种: ____________ ,
________________ 。
(3)装置乙的试管口部放有一团浸有碱液的棉花,棉花中通常是浸有饱和碳酸钠溶液,写出棉花中发生反应的化学方程式___________________________________。
14. (12分)有两个实验小组的同学为探究过氧化钠与二氧化硫的反应,都用如下图所示的装置进行实验。通入SO2气体,将带余烬的木条插入试管C中,木条复燃。
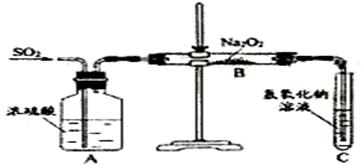
请回答下列问题:
(1) 第1小组同学认为Na2O2与SO2反应生成了Na2SO3和O2,该反应的化学方程式是: 。
(2) 请设计一种实验方案证明Na2O2与SO2反应生成的白色固体中含有Na2SO3。
。
(3) 第2小组同学认为Na2O2与SO2反应生成了Na2SO3和O2外,还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

上述方案是否合理? 。请简要说明理由:
① ;② 。
15.(2007年高考全国理综卷I,15分)A、B、C、D、E均为可溶于水的固体,组成它们的离子有
| 阳离子 | Na+ | Mg2+ | Al3+ | Ba2+ | |
| 阴离子 | OH- | Cl- | CO32 - | SO42 - | HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液;
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液;
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸;
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减小,但不消失。
据此推断它们是A__________;B___________;C__________;D___________;E___________。
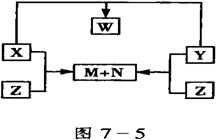 16.(15分)化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如图7-5所示(无被省略的物质):又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
16.(15分)化合物X、Y、Z是由短周期的三种元素两两结合而成,X、Y、Z之间的转化关系如图7-5所示(无被省略的物质):又知:X、N、W均为液态物质,且X与N的组成元素相同。试回答:
(1)上述转化关系图中生成W涉及到的基本反应类型是__________________。
(2)X、Y、Z、W的化学式依次是:X_________、Y_________、Z____________、W____________。
(3)写出X与Y、X与Z反应的化学方程式:X+Y:_________________________________;
X+Z:_________________________________。
高三化学复习单元测试(6)—氧族元素 环境保护参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | A | A | A | D | B | A | C | D | D | A | A | C |
13. (1)乙中品红褪成无色;甲中溶液显蓝色。Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O。
(2)装置甲试管内溶液变黑色浑浊;装置甲中试管上部有白雾;反应开始时铜片表面变黑并有气泡产生……
(3)Na2CO3+SO2=Na2SO3+CO2↑
14. 【答案】20. (12分)(1) 2Na2O2+2SO2=2Na2SO3+O2
(2) 取白色固体,加稀硫酸,产生能使品红溶液褪色的气体。
(3) 不合理;稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它能溶于水后能将亚硫酸根氧化成硫酸根
15. [答案]A:Na2CO3;B:Al2(SO4)3;C:MgCl2;D:Ba(OH)2;E:NaHSO4[或Mg(HSO4)2]。
16. (1)化合反应:(2)![]() ;
;![]() ;
;![]() ;
;![]()
(3)![]()