高三化学复习单元测试(3)—物质的量
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 He:4 C:12 O:16 S:32 N:14 Cl:35.5 K:39 Na:23 Ca:40 Al:27
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题6分,共8题)
1.(2007年高考上海化学卷)下列有关物理量相应的单位表达错误的是( )
(A)摩尔质量g/mol (B)气体摩尔体积L/mol (C)溶解度g/100g (D)密度g/cm3
2.(2007年高考广东)已知阿伏加德罗常数为NA,下列说法正确的是( )
(A)2 mol重水含有NA个D2O分子 (B)1 g氢气含有NA个H2分子
(C)2 mol钠与过量稀盐酸反应生成NA个H2分子 (D)22.4 L水含有NA个H2O分子
3.(2007年高考广东化学卷,)下列叙述正确的是( )
(A)48 g O3气体含有6.02×1023个O3分子
(B)常温常压下,4.6 g NO2气体含有1.81×1023个NO2分子
(C)0.5 mol·L-1 CuCl2溶液中含有3.01×1023个Cu2+
(D)标准状况下,33.6 L H2O含有9.03×1023个H2O分子
4.(2007年高考海南化学卷)下列叙述正确的是( )
(A)一定温度、压强下,气体体积由其分子的大小决定
(B)一定温度、压强下,气体体积由其物质的量的多少决定
(C)气体摩尔体积是指1 mol任何气体所占的体积为22.4 L
(D)不同的气体,若体积不等,则它们所含的分子数一定不等
5. (2007年高考全国理综卷I)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是( )
(A)p(Ne)>p(H2)>p(O2) (B)p(O2)>p(Ne)>p(H2)
(C)p(H2)>p(O2)>p(Ne) (D)p(H2)>p(Ne)>p(O2)
6.(2007年高考理综宁夏卷)a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为( )
(A)1:7 (B)7:1 (C)7:8 (D)8:7
7.(2007年高考海南化学卷)有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为( )
(A)(y-2x)/a (B)(y-x)/a (C)(2y-2x)/a (D)(2y-4x)/a
8.(2007年高考上海化学卷)往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量m(沉淀)与加入AgNO3溶液体积V(AgNO3)的关系如图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
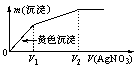
(A)(V2-V1)/V1 (B)V1/V2 (C)V1/(V2-V1) (D)V2/V1
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
第Ⅱ卷(非选择题共60分)
9.①(8分)由A、B两气体组成的混合气体8.6 g,在标准状况下占有体积为8.96 L,已知A和B的物质的量之比为3∶1,摩尔质量之比为14∶1,则A可能是 、 、 ;B 。
②(6分)在无土栽培中,配制1 L内含0.5 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液,若用KCl、NH4Cl、(NH4)2SO4配制,则需这三种固体的物质的量分别为 、 、 。
③(6分)标准状况下11.2L,由CO和![]() 组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为_______;此混合气体完全燃烧消耗氧气的体积(标准状况)为___________L;将燃烧产物通过足量过氧化钠后,固体增重___________g。
组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为_______;此混合气体完全燃烧消耗氧气的体积(标准状况)为___________L;将燃烧产物通过足量过氧化钠后,固体增重___________g。
10.(18分)现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有 (填代号)。
(2)经计算,需浓H2SO4的体积为 现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是 。
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度 处。
改用 加蒸馏水到瓶颈刻度的地方,使溶液的 。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:
错误的是 ,能引起误差偏高的有 (填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容时,俯视标线
⑦定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
11. (12分)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:xCuCO3·yCu(OH)2(x、y为正整数且x≤2,y≤2)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石消耗的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1,请推算它们的化学组成。
孔雀石__________________________;石青__________________________;
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36 L(标准状况下);加热另一份样品使其完全分解,得到CuO 20 g,通过计算确定该混合物中孔雀石和石青的物质的量之比为: 。
12. (10分)现有等物质的量的![]() 和
和![]() 的混合物ag与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
的混合物ag与100mL盐酸反应。题中涉及的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中![]() 与
与![]() 的质量比为____________。
的质量比为____________。
(2)如碳酸氢盐与盐酸恰好完全反应,则盐酸的浓度为______________![]() 。
。
(3)如盐酸过量,生成![]() 体积为__________L。
体积为__________L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成![]() 的体积,还需要知道______________。
的体积,还需要知道______________。
(5)若![]() 和
和![]() 不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成
不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成![]() 的体积(V)范围是____________。
的体积(V)范围是____________。
参考答案第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | C | A | B | D | B | D | C |
9.① N2、CO、C2H4、H2 ② 0.64、0.02、0.24 ③![]() ;5.6;7.2
;5.6;7.2
10. (1)②⑦⑧(2)5.43、①(3)500、引流、烧杯、1-2cm、胶头滴管、凹液面与刻度线相切(4)①②③④⑥⑦、①②⑥
11. (1)设孔雀石的化学式为xCuCO3•yCu(OH)2
则依题意 = = 孔雀石的化学式为 CuCO3•Cu(OH)2
又设石青的化学式为 xCuCO3•yCu(OH)2
则依题意 = = 石青的化学式为 2CuCO3•Cu(OH)2
(2)设该样品中孔雀石物质的量分数为x,则石青为 1- x
= = 孔雀石与石青物质的量之比为1:1
12. (1)84:100 (二者以等物质的量混合。质量比即摩尔质量之比)
(2)5a/46 提示:设盐酸的物质的量浓度为![]()
![]()
84 1
84a/184
0.1/2
x=5a/46如果以![]() 为基准来计算,可得到同样的结果。
为基准来计算,可得到同样的结果。
(3)5.6a/23 提示:盐酸过量时,生成的![]() 的体积为V:
的体积为V:
![]()
84 22.3
84a/184 V/2 ∴V=22.4a/92 L或5.6a/23L
(4)盐酸的物质的量浓度 提示:如果盐酸不足量,则应该用盐酸的量为基准进行计算,这就需要知道盐酸的物质的量浓度。
(5)22.4a/100L<V<22.4a/84L
提示:可以考虑两个极端时的情况,若固体全部为![]() ,可放出
,可放出![]() ,若固体全部为
,若固体全部为![]() ,则可放出
,则可放出![]() ,因此体积范围是:22.4a/100L<V<22.4a/84L。
,因此体积范围是:22.4a/100L<V<22.4a/84L。