08届高三化学物质的量单元测试题
(第三章 物质的量)
考试时间:75分钟
班级_______________姓名__________________分数__________________
一、选择题(每题3分,共48分,每题只有一个正确选项)
1.下列关于物质的量的叙述中,错误的是( )
A.0.012 Kg 12C 中含有约 6.02×1023 个碳原子
B.1 mol SO2 在标准状况下的体积约为 22.4 L
C.1 mol 水中含有 2 mol 氢和 1 mol 氧
D.1 mol Ne 含有约 6.02×1024 个电子
2.下列有关气体体积的叙述中,正确的是( )
A.在一定的温度和压强下,各种气态物质体积大小由构成气体分子大小决定
B.在一定的温度和压强下,各种气态物质体积的大小由构成气体的分子数决定
C.不同的气体,若体积不同,则它们所含的分子数一定不同
D.气体摩尔体积是指1 mol任何气体所占的体积约为22.4L
3.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0℃,1.01×106Pa时,11.2L氧气所含的氧原子数为NA
B.标准状况下,80gSO3所占的体积约为22.4L
C.在同温同压下,相同体积的任何气体单质所含的原子数目相同
D.35.5gCl2作氧化剂参加反应时可接受NA个电子
4. 若将等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-完全沉淀,需用相同浓度的AgNO3溶液的体积比为3∶2∶1,则上述三种溶液的体积比为( )
A.9∶4∶1 B.3∶2∶1 C.6∶3∶2 D.9∶3∶1
5.配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
A.容量瓶事先未烘干 B.空盘时天平指针向标尺右边偏转
C.定容时观察液面仰视 D.溶解后立即转移到容量瓶进行定容
6.某温度下,在100g水中加入mgCuSO4或加入ngCuSO4·5H2O,均可使溶液恰好达到饱和,则m与n的关系符合( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
 7.如图,标准状况下,向带有活塞的最大容积为120 L的密闭容器中充入a mol
H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )
7.如图,标准状况下,向带有活塞的最大容积为120 L的密闭容器中充入a mol
H2S和b mol SO2(a、b为正整数;a≤5,b≤5),则反应完全后,容器内气体可能达到的最大密度(g/L)是( )
A.4.40 B.8.00 C.5.60 D.2.86
8.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
A.504 mL B.336 mL C.224 mL D.168 Ml
9.在两个容积相同的容器中,一个盛有HCl气体,另一个盛有H2和Cl2的混合气体。在同温同压下,两容器内的气体一定具有相同的是( )
A.原子数 B.相对分子质量 C.质量 D.密度
10.右图是某物质的溶解度曲线,根据该图判断下列说法错误的是( )
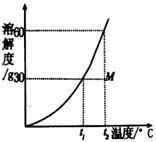 A.M点对应的溶液是t2℃的不饱和溶液
A.M点对应的溶液是t2℃的不饱和溶液
B.在保持溶质和和溶剂质量不变的情况下,使M点溶液达到饱和需降温 (t2-t1)℃
C.130 g M点溶液最少要蒸发50 g水后才能成为t2℃的饱和溶液
D.若保持温度不变,100 g M点溶液需含溶质60 g才能达饱和
11.由CO、H2和O2组成的混和气体60 mL,在一定条件下恰好完全反应,测得生成物在101kPa 120℃下对氢气的相对密度为18.75,则原混和气体中H2所占的体积分数为( )
A. 1/6 B. 2/3 C. 1/4 D. 1/3
12.若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
A.氖元素的相对原子质量一定是12a/b
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量一定是(10W/a NA) mol
D.Wg该氖原子所含质子数是10W/a
13.将100g浓度为18mol·L━1、密度为p g·cm━3的浓硫酸加入到一定量的水中,使之稀释成9 mol·L━1的硫酸,则需水的体积为( )
A.小于100mL B.等于100mL C.大于100mL D.等于100/p mL
14.某温度下,MgCl2饱和溶液的浓度为40%,在足量此溶液中加入4.6g无水MgCl2,最终析出水合物晶体40.6g,则该水合物晶体的化学式是( )
A.MgCl2·7H2O B.MgCl2·2H2O C.MgCl2·5H2O D.MgCl2·6H2O
15.某含氧强酸HmXOn,相对分子质量为A,将它溶于水,测得溶液的氢离子浓度为2mol/L,溶液的质量分数为20% ,密度为1.5g/cm3,则m值为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
16.原子虽小,但也有一定的体积。已知铜的密度为 ρ= 8.9×103 kg·m-3 ,铜的相对原子质量为 64 ,通过估算可知一个铜原子的体积约为( )
A.8×10━24 m3 B.1.2×10━26 m3 C.1.2×10━29 m3 D.7×10━6 m3
选择题答案表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题(共4小题,计26分)
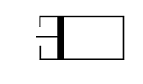
17.(6分)某学生用已知质量yg的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示):
(1)下面他的操作应该是 ,使 。
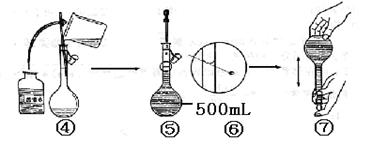
(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号) 。
18.(6分)将4mLO2和3mlNxHy(y>x)混合气体在150℃和1.05×105Pa下点燃,完全反应后,恢复到原来的温度与压强时,测得反应后N2、O2、H2O(g)混合气体比原混合气体的密度减少3/10.
(1)此反应的化学方程式是(用NxHy表示)__________________________
(2)推算NxHy化学式的根据是 ___________
(3)x与y的关系式为__________________
19.( 6分 ) (1)48 g RO42- 中,核外电子总数比质子总数多 6.02×1023 个,则 R 元素的
摩尔质量为 。
(2)同温同压下,测得氢气的密度为 0.089 g·L-1 ,某种有刺激性气味的气体 X 的
密度为 2.857 g·L-1 。又知此气体是三原子分子且由两种元素组成,两种元素的质量比
为 1:1 。则该气体 X 的化学式为 。
(3)有一真空瓶的质量为 M1 g ,该瓶充入空气后总质量为 M2 g ;在相同状况下,
若改充某气体 A 后,总质量为 M3 g ,A 的相对分子质量为 。
20.(8分)常温下A和B两种气体组成的混合气(A的相对分子质量小于B的相对分子质量)中只含有氮和氢两种元素,而且不论A和B以何种比例混合,氮和氢的质量比总大于14/3。由此可确A为 , 为 ,其理由是 。若上述气体中氮和氢的质量比7:1,则在混合气体中A和B的物质的量之比为 ,在混合气体中A的体积分数为 。
三.计算题(共2小题,计26分)
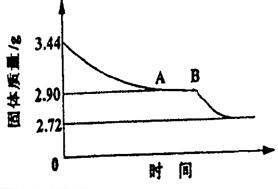
21.(12分)某校课外活动小组为测定生石膏的组成(CaSO4·xH2O),即测定x值,做如下实验:将生石膏放在坩埚中加热,加热前、后都进行称量。随实验次数增加,加热时间不断延长,最后整理加热前后固体质量数据如下表(下右图为根据数据绘制的图象):
| 实验顺序 | 加热前(g) |
| ||
| 1 | 3.44 | 3.26 | ||
| 2 | 3.44 | 3.12 | ||
| 3 | 3.44 | 2.90 | ||
| 4 | 3.44 | 2.90 | ||
| 5 | 3.44 | 2.80 | ||
| 6 | 3.44 | 2.78 | ||
| 7 | 3.44 | 2.72 | ||
| 8 | 3.44 | 2.72 |
(1)利用实验数据,通过计算推断生石膏的化学式。
(2)通过计算解释图像中产生AB段的原因。
(3)若将所得的固体残渣继续升温灼烧,发现质量还会减轻,简述你认为可能的原因。
![]() 22. (14分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)
22. (14分) 将51.2gCu完全溶于适量浓硝酸溶液中,收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共Amol,将这些气体完全通入足量烧碱溶液,充分反应后,共消耗NaOHBmol。(有关反应方程式:①N2O4 2 NO2 ;②2NO2+2NaOH=NaNO2+NaNO3+H2O
;③NO+NO2+2NaOH=2NaNO2+H2O)
(1)若A=0.8,则原0.8mol混合气体能否被烧碱溶液完全吸收?若能,当B=1.0时,原0.8mol混合气体中各气体的物质的量为多少?若不能,该问不用回答。
(2)若仅已知A=0.8,试求B值的范围。
(3)求A=0.8时,气体与碱反应所得溶液中NaNO3的物质的量(可用含有关字母的代数式表示)。
参 考 答 案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | D | D | C | B | D | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | D | A | D | A | D | B | C |
17.继续加入样品(2分) 指针指在标尺的中间(2分) ①③⑥(4分);
18. (1)4NxHy+yO2=2xN2+2yH2O
(2)质量守恒定律和阿佛加德罗定
(3)2x+y=8
19.(1) 32 g·mol-1 (2) SO2
(3) ×29
20.NH3 、N2 ;纯NH3中N和H的质量比为14/3,混入N2将使N和H的质量比大于14/3;
4:1 ; 80%
21.(1) CaSO4·xH2O CaSO4 +
xH2O
136+18x 136 18x
3.44 2.72 0.72
x=2 CaSO4·2H2O (4分)
|
CaSO4·2H2O CaSO4
· yH2O+(2-y)H2O
172 136+18y
3.44 2.90
![]() (4分)
(4分)
加热过程中生石膏转化成相对稳定的2CaSO4·H2O,所以图象中存在一段时间内质量不变的AB段。
(3)CaSO4受高温灼烧还可以继续分解放出气体。(1分)
22.(1)能;NO为0.3mol,
N2O4为0.2mol,NO2为0.3mol。
(2)0.8<B<1.6 ;
(3)B-0.8