08届高三化学第一学期六校联考试题
可能用到的相对原子质量:H~1,C~12,N~14,O~16,Na~23,Mg~24,Al~27,S~32,
Cl~35.5,K~39,Ca~40, Fe~56,Cu~64,Zn~65。
一、选择题(本大题包括16个小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.下列说法正确的是
A.得电子越多氧化性越强 B.含共价键的化合物为共价化合物
C.离子个数越多导电能力越强 D.过渡元素都是金属元素
2.下列说法错误的是
A.CO2和漂白粉作用,可生成具有氧化性的物质
B.SiO2与烧碱溶液反应后,溶液的碱性一定减弱
C.SO2通入氢硫酸溶液中,溶液的酸性一定减弱
D.NO2分子在一定条件下可以相互结合为N2O4分子
3.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.加入少量水,水的电离平衡向正反应方向移动
B.再通入少量氯气,c(H+)/c(ClO-)减小
C.通入少量SO2,溶液漂白性增强
D.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)
4.GaAs是一种新型化合物半导体材料,其性能比硅更优越。Ga位于周期表的第ⅢA族,As位于周期表的第ⅤA族。下列说法不正确的是
A.Ga和As的最外层电子数分别是3和5
B.GaAs中Ga和As的化合价分别为+3和-3
C.N、P、As氢化物的沸点依次升高
D.Ga的最高价氧化物对应水化物碱性较Al(OH)3强
5.在5L密闭容器中,1molA和3molB在一定条件下反应:A(g)+mB(g)![]() 2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是
2C(g),经3min反应达到平衡状态,测得混合气体共3.2mol,其中含0.8molC,则下列说法不正确的是
A.m值等于3
B.平衡时,体系中c(A)∶c(B)∶c(C)=4∶9∶8
C.A的转化率为40%
D.用B表示该反应的平均反应速率为0.08mol·L-1·min-1
6.下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
7.将5.4 g Al 投入到200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
A.HCl溶液 B.HNO3溶液
C.H2SO4溶液 D.Ba(OH)2溶液
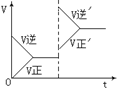 8.如图,在密闭容器中反应:C(s)+H2O(g)
8.如图,在密闭容器中反应:C(s)+H2O(g)![]() CO(g)+H2(g)
(吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是
CO(g)+H2(g)
(吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是
A.增加CO浓度 B.增大压强
C.升高温度 D.增加水蒸气
9.下列化学反应的离子方程式正确的是
A.用小苏打治疗胃酸过多: CO32-+2H+=CO2↑+H2O
B.二氧化碳与少量的NaOH反应: CO2+OH-=HCO3-
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
10.将AlCl3溶液和NaAlO2溶液分别蒸发并灼烧,所得产物的主要成份是
A.均为Al(OH)3 B.前者得AlCl3,后者得NaAlO2
C.均为Al2O3 D.前者得Al2O3,后者得NaAlO2
 11.右图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是
11.右图表示相同质量的Mg、Al分别跟一定量的稀H2SO4溶液反应的情况,下列叙述可能符合图示的是
A.Mg、Al均不足,H2SO4过量
B.消耗稀H2SO4的量是Ⅱ大于Ⅰ
C.Ⅰ表示Mg与稀H2SO4反应
D.产生H2的速率是Ⅱ大于Ⅰ
12.下列关于实验现象的描述不正确的是
A.把锌片和铁片用导线相连,浸入氯化铜溶液,铁片表面出现一层铜
B.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率加快
D.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
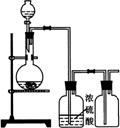
13.可用右图装置制取(必要时可加热)、净化、收集的气体是
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
14.假设体积可以相加,下列叙述正确的是
A.0.2 mol·L-1的盐酸,与等体积水混合后pH=1
B.pH=3的醋酸溶液,稀释至10倍后pH=4
C.95 ℃纯水的pH<7,说明加热可导致水呈酸性
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=7
15.一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.1000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
提示:①H2C2O4是二元弱酸;
②10[KHC2O4·H2C2O4]+8KMnO4+17H2SO4=8MnSO4+9K2SO4+40CO2↑+32H2O
A.0.08000 B.0.008889 C.0.1200 D.0.2400
16.把ag铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液。过滤出沉淀,经洗涤、干燥、灼烧,得到红棕色粉末的质量仍为ag,则原合金中铁的质量分数为
A.30% B.47.6% C.52.4% D.70%
二、填空题(本题共4小题,共30分)
17.(6分)下表由元素周期表的前三周期去掉副族上方的空白区域后组合而成,表中虚线处为ⅡA、ⅢA族的连接处。请用相应的化学用语回答下列问题:
| a | |||||||
| b |
|
| c | d | e | f | |
| g | h |
(1)写出仅由e形成的两种带有相同电荷数的阴离子的符号: 、 。
(2)h的单质能与g元素的最高价氧化物对应的水化物的溶液反应,请写出该反应的离子方程式 。
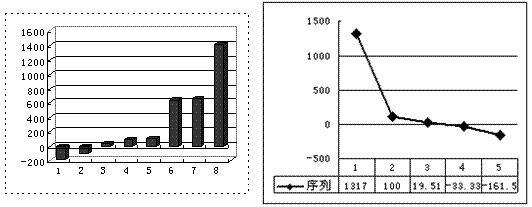
(3)上左图是表示第三周期8种元素单质的熔点(℃)柱形图,已知柱形“1”代表Ar,则其中柱形“8”代表 。(填化学式)
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图(上右图),序列“5”的氢化物的名称是 ,序列“2”的氢化物的结构式为 。
18.(8分)
(1)将等体积等物质的量浓度的盐酸和氨水混合后,呈_____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;
(2)将PH=3的盐酸和PH=11的氨水等体积混合后溶液呈____性,溶液中c(NH4+)与c(Cl-)的大小关系是___________________;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中c(NH4+)与c(Cl-)浓度相等,则混合溶液呈_____性,与体积大小关系是_________________;
(4)将m mol· L-1的盐酸和n mol·L-1氨水等体积混合后,溶液的PH=7,m与n的大小关系是
,则盐酸中c(H+)与氨水中c(OH-)的大小关系是_______。
19.(8分)下图是常见无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,B和C都是极易溶于水的气体,C与AgNO3溶液反应生成不溶于稀硝酸的白色沉淀,E是一种红棕色气体,I是红褐色沉淀,K是由第三周期元素组成的单质中熔点最高的金属。
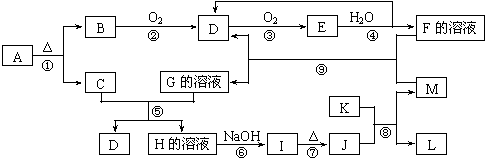 |
请填写下列空白:
(1)B分子的电子式为____________________________
(2)在反应②中氧化剂与还原剂的物质的量之比为___________________。
(3)写出反应⑧的化学方程式 。
(4)反应⑤的离子方程式是:__________________________________________。
20.(8分)
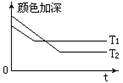 (1)反应A+B
(1)反应A+B![]() 2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,
2C,其中A为有色气态物质,其混合物颜色深浅与反应时间,
温度(T)之间的关系如图所示(B、C均为无色物质):
①该反应是_______热反应;
②若A、B、C均为气态物质,增大压强,B的转化率________,混合气体的颜色 。
(2)化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH—
NH4++OH—
①向氨水中加入MgCl2固体时,平衡向 移动,OH-的浓度_______,NH4+的浓度 。
②向浓氨水中加入少量NaOH固体,平衡向 移动,此时发生的现象 。
三、实验题(共10分)
21.(10分)某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,加热使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
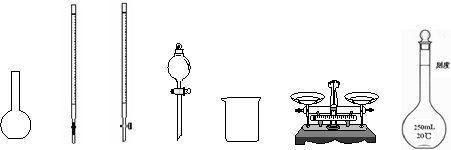 (1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
A B C D E F G
(2)写出步骤③中发生反应的离子方程式 。
(3)洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作是 。
(4)若坩埚质量是W1,坩埚于加热后固体总质量是W2,则样品中铁元素的质量分数为 。
(5)该兴趣小组中甲学生认为:实验步骤③中不加入氯水,其余步骤不变,仍可达到目的。你认为甲学生的观点是否正确 (填正确或错误),请说明理由: 。
四、计算题(本题共2小题,共12分)
22.(5分)将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2![]() 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
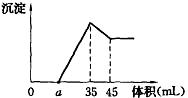 23.(7分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,
23.(7分)准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),放入100mL浓度的H2SO4溶液中,充分反应后过滤,向滤液中加入10mol/L的NaOH溶液,产生沉淀与加入NaOH溶液的体积的关系如右图所示,
求:(1)H2SO4溶液的物质的量浓度;
(2)若a=2.3mL,计算各组分的质量;
高三化学参考答案
一、选择题(本大题包括16个小题,共48分。每小题只有一个选项符合题意)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | A | C | B | D | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | B | D | C | D | B | A | A | D |
二、填空题(本题共4小题,共30分)
17.(6分,每空1分)(1)O2-、O22-(或O2-、O3-)(2)2OH-+2Al+2H2O=2AlO2-+3H2↑
(3)Si (4)甲烷 H—O—H
18.(8分,每空1分)
(1) 酸 ,c(Cl-)>c(NH4+) ; (2) 碱 ,c(NH4+)>c(Cl-);
(3) 中 ,V(氨水)>V(盐酸); (4) m<n ,c(H+)>c(OH-)。
19.(8分,每空2分)
![]() (1)
(1)
(2)5∶4
(3)2Al+Fe2O3![]() 2Fe +Al2O3
2Fe +Al2O3
(4)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
20.(8分,每空1分)
(1)①放 ②不变 加深
(2)①正反应方向 减小 增大 ②逆反应方向 氨水中有刺激性气体产生
三、实验题(共10分)
21.(10分)
(1)C F G(1分)
(2)2Fe2+ +Cl2=2Fe3++2Cl- (2分)
(3)NH![]() 、Cl-、OH-(1分);
、Cl-、OH-(1分);
向漏斗里注入蒸馏水,使水面没过滤渣,等水自然流完后,重复操作2~3次。(1分)
(4)![]() ×2×56g/mol×
×2×56g/mol×![]() ÷
÷![]() g×100%=
g×100%=![]() (2分)
(2分)
(5)正确(1分),FeCl3、FeCl2溶液中加入过量氨水,生成Fe(OH)3和Fe(OH)2沉淀,在操作过程中Fe(OH)2会被空气进一步氧化生成Fe(OH)3,最后所得生成物只有Fe2O3,对实验结果无影响。(2分)
四、计算题(本题共2小题,共12分)
22.(5分)
解:得,M始=![]() =7.2g·mol-1
M平=2×4.19=8.38g·mol-1
n始=2+8=10mol(1分)
=7.2g·mol-1
M平=2×4.19=8.38g·mol-1
n始=2+8=10mol(1分)
∵反应前后气体的质量不变,∴n始M始=n平M平 (1分)
n平=![]() =
=![]() =8.6mol(1分)
=8.6mol(1分)
设N2的转化率为x
由反应
N2 + 3H2 ![]() 2NH3
2NH3
n始 2mol 8mol 0
n变 2x mol 6x mol 4x mol
n平 (2-2x)mol (8-6x)mol 4x mol
∴ (2-2x)+(8-6x)+4x=8.6
x=0.35=35%(35.1%,35.2%均给分)(2分)
23.(7分)
解:(1)35~45mL为 Al(OH)3 + NaOH = NaAlO2 + 2H2O
1 1
10×0.01 n(NaAlO2)
n(NaAlO2)=10×0.01=0.1mol=2n(Al2O3)
n(Al2O3)=0.05mol n(Al3+)=0.1mol
反应到45mL 溶液中只有NaAlO2和Na2SO4
n(NaOH)总=n(NaAlO2)+2n(Na2SO4)
n(Na2SO4)=(10×0.045-0.1)/2=0.175mol =n(H2SO4)
c(H2SO4)=![]() =1.75mol·L-1 (2分)
=1.75mol·L-1 (2分)
(2)m(Al2O3)=0.05×102=5.1g (1分)
3n(Al3+)+3 n(Fe3+)=(35-2.3)×10-3×10=0.327
n(Fe3+)=0.109-0.1=0.009mol
m(Fe2O3)=![]() =0.72g
(2分)
=0.72g
(2分)
m(SiO2)=6-0.72-5.1=0.18g (2分)