08届高三化学元素及其化合物专题复习试题
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Pt 195
第Ⅰ卷 选择题(共70分)
一.选择题(本题包括10小题,每小题3分,共30分。每小题只有1个选项符合题意)
1、我国在全国各省、市、自治区的主要城市都设有大气监测站。北京更是由分布在城区的各监测点组成一个监测网,又监测大气情况,且每天都公布空气质量。下面所列各项,在空气质量日报中完全正确的是
①可吸入颗粒物 ②总悬浮颗粒物 ③氮氧化物 ④二氧化碳 ⑤二氧化硫 ⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.②③⑤⑥⑦ C.②⑤⑥⑦⑩ D.①⑤⑥⑦⑩
2、(2007年高考全国理综卷I)下列有关环境问题的说法正确的是( )
(A)燃煤时加入适量石灰石,可减少废气中SO2的量
(B)臭氧的体积分数超过10-4%的空气有利于人体健康
(C)pH在5.6~7.0之间的降水通常称为酸雨
(D)含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
3、.下列物质中,不含有硅酸盐的是
A.水玻璃 B.硅芯片 C.黏土 D.普通水泥
4、生产、生活离不开各种化学物质,下列说法不正确的是
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
5.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是:
A.已经制得了 IBr、ICl 等卤素互化物
B.已经制得 I2O5 等碘的氧化物
C.已经制得了I (NO3)3、I (ClO4)3·2H2O等含 I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
6.下列有关氯元素单质及化合物的性质的说法正确的是
A.液氯是纯净物,而氯水是电解质,漂白粉是混合物
B.氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性
C.随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强
D.氯化铝受热易升华,加压下加热得到熔融氯化铝不导电,故氯化铝是共价化合物
7.随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中可装入的物质是
A.无水硫酸铜、蔗糖 B.硅胶、硫酸亚铁 C.食盐、硫酸亚铁 D.生石灰、食盐
8.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
9、(2007年高考广东理基)某溶液中可能含有SO42 -、CO32 -、Cl-。为了检验其中是否含有SO42 -,除BaCl2溶液外,还需要的溶液是
![]()
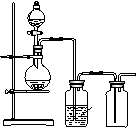 (A)H2SO4
(B)HCl
(C)NaOH
(D)NaNO3
(A)H2SO4
(B)HCl
(C)NaOH
(D)NaNO3
10、(07年上海卷)可用如图装置制取(必要时可加热)、净化、收集的气体是
(A)铜和稀硝酸制一氧化氮 (B)氯化钠与浓硫酸制氯化氢
(C)锌和稀硫酸制氢气 (D)硫化亚铁与稀硫酸制硫化氢
二、选择题(本题包括10小题,每小题4分,共40分。每小题有个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只先一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11、化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A.定性检验SO![]() ,将BaCl2溶液用HNO3酸化
,将BaCl2溶液用HNO3酸化
B.检验某溶液中是否含Cl – ,用HNO3酸化的AgNO3溶液
C.为了提高KMnO4溶液的氧化能力,用盐酸将其酸化
D.配制FeCl2溶液时通常加少量HNO3酸化,减小其水解程
12、用铝箔包住0.2mol金属钠,然后用针扎若干小孔,放入水中,完全反应后,用排水集气法收集到的气体(标准状况下)为
A. H2和O2的混合气体 B.= 2.24L H2 C. >2.24L H2 D.< 2.24L H2
13、下列各组离子在指定条件下,—定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3-
B.c(H+)=10—1mol/L的溶液中:Cu2+、Al3+、SO42—、NO3—
C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br-
D.水电离出的c(H+)=10-12mol/L的溶液中:Na+、Mg2+、Cl-、SO42-
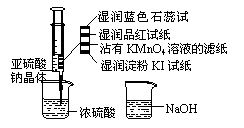 14、如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
14、如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是
A.蓝色石蕊试纸先变红后褪色
B.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明 SO2的漂白性
C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2
D.NaOH溶液可用于除去实验中多余的SO2
15、常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
16、(成都)工业上用固体硫酸亚铁制取颜料铁红( Fe2O3) ,反应原理是:
![]()
某学生欲检验该反应所产生的气态物质,他依次将气体通过盛有(I) BaCl2溶液、 ( II ) x 溶液、(III) NaOH 溶液的三个装置。则下列对该方案的评价中正确的是
A.( I )中会生成 BaSO3、 BaSO4两种沉淀
B.可将( I )中的 BaCl2溶液改为 Ba ( NO3 )2溶液
C. (II)所盛 x 应为品红溶液
D. ( III)的作用是检验生成的SO2 气体
17、对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+等微粒)。分别进行如下实验:①加热时放出的气体可使品红溶液褪色②加碱调pH至碱性后,加热时放出的气体可使润湿的红色石蕊试纸变蓝③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀NHO3。对于上述微粒不能确认其在原溶液中是否存在的是
A.Br- B.SO42- C.H2SO3 D.NH4+
18、下列实验方法:①用渗析法分离蛋白质和葡萄糖的混合液②用盐析法分离法油皂化反应的产物③用升华法分离I2和砂子的混合物④用重结晶法分离KNO3和NaCl的混合物⑤用分液法分离H2O和C2H5-Br的混合物⑥用蒸馏法分离C2H5OH与C6H5-OH(沸点为182℃)的混合物。你认为上述方法 ( )
A.只有①不正确 B.②⑤⑥不正确 C.只有③④⑥正确 D.全部正确
19、某溶液中含HCO3-、SO32-、CO32-、NO3-、Na+等五种离子,若向其中加入足量Na2O2后(设溶液体积不变),溶液中上述离子浓度基本保持不变的是
A、NO3- B、SO32- NO3- C、CO32- NO3- D、CO32-、NO3- Na+
20、(07江苏卷)某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
(A)若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
(B)若金属全部溶解,则溶液中一定含有Fe3+
(C)若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3
(D)当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
2008英德市二中元素及其化合物专题复习月考试题
班级 姓名 座号 成绩
第Ⅱ卷 非选择题(共80分)
一、二选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
三、(本题包括2小题,共22分)
21、有一瓶溶液只含Cl-、![]() 、
、![]() 、Na+、
、Na+、![]() 、K+、Mg2+ 七种离子中的某几种。经实验:
、K+、Mg2+ 七种离子中的某几种。经实验:
(1) 原溶液 ![]() 白色沉淀 (2)
将(1)所得溶液
白色沉淀 (2)
将(1)所得溶液 ![]() 放出使紫色石蕊试液变蓝的气体
放出使紫色石蕊试液变蓝的气体
(3) 原溶液中加BaCl2溶液不产生沉淀
(4)原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解
回答下列问题: (1)原溶液中一定含有的离子是______________ _______,一定不含有的离子是 ,可能含有的离子是 。
(2)有同学认为实验(4)可以省略,你认为呢?(填“可以”或“不可以”) ,
说明理由 。
(3)可能含有的离子如何加以确定?
。
22、(07海南化学卷) (10分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________________ ___________;
(2)写出“联合制碱法”有关反应的化学方程式:_______________________________________;
__________________________ ____________。
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?__________________________________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式: 原子利用率(%) =________________________________________。
四、(本题包括2小题,共28分)
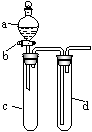 23、(2007年高考理综重庆卷)(14分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
23、(2007年高考理综重庆卷)(14分)某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和
d的胶塞,加热c,其目的是_______ _______
_ _。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入
2 mL浓硝酸,c中反应的化学方程式是 ______________。
再由a向c中加2 mL蒸馏水,c中的实验现象是___________ _____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是______ _,理由是__ _
| 方案 | 反应物 |
| 甲 | Cu、浓HNO3 |
| 乙 | Cu、稀HNO3 |
| 丙 | Cu、O2、稀HNO3 |
___________________ ______。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,
操作步骤为_______________________ _________
___ __,
实验现象为_______________________________ ____ _________;
但此实验的不足之处是__________________ _________。
24、(14分)已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1 mol/L硫酸、2 mol/L硝酸、2 mol/L NaOH溶液、20% KSCN溶液。
完成以下实验探究过程:
(1)提出假设:假设1:该混合金属粉末中除铝外还含有_______ __元素;
假设2:该混合金属粉末中除铝外还含有_________ 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案:基于假设3,设计出实验方案(不需要作答)。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
五、(本题包括2小题,20分)
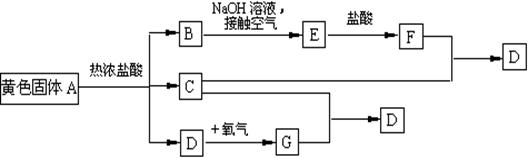 25、(10分)物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
25、(10分)物质A、D及F的水溶液均呈黄色,D是单质,F的溶液遇苯酚显紫色,A是一种重要工业生产中的主要原料。且A、C、D均含有某一非金属元素,C的相对分子质量与过氧化氢的相对分子质量相等。反应过程中生成的水等与转化无关的物质已经略去。这些物质有以下转化关系。试回答以下问题:
(1)A是 ,C是 ,F是 (均填化学式)。
(2)A与热盐酸反应的离子方程式为
(3)写出该框图中由B→E的化学方程式 。
26、(10分)红矾(重铬酸钠Na2Cr2O7)是一种非常重要的工业产品;工业上生产红矾的工艺流程如下:
①铬铁矿(可视为FeO·Cr2O3、还含有Al2O3、SiO2)与纯碱、石灰石混合后通过空气焙烧(使铬转化为+6价化合物)
②焙烧产物加水后,并用硫酸调成中性溶液
③过滤、滤液加硫酸酸化、浓缩、结晶成红矾
(1)完成下列化学方程式:
SiO2+CaCO3![]() ;
;
Al2O3+Na2CO3![]() 。
。
(2)配平下列反应方程式,填上系数:
FeO·Cr2O3+ Na2CO3+ O2 ¾¾ Na2CrO4+ Fe2O3+ CO2
(3)用水浸取焙烧产物,并用硫酸调成中性的目的是 。
并写出有关的离子方程式 。
六、(必做题。本题包括1小题,10分)
27、(2007年高考江苏卷)(10分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:__________________ ____、_________________________________________。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。
①导致溶液温度降低的原因可能是___________________________________________;
②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为_____________;
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是___ ______
______________ _______。
(3)能用于测定硫酸尾气中SO2含量的是____ _____。(填字母)
(A)NaOH溶液、酚酞试液 (B)KMnO4溶液、稀H2SO4
(C)碘水、淀粉溶液 (D)氨水、酚酞试液
答案
一、二选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | D | A | B | D | C | D | B | B | B | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | B | C | B | CD | C | C | B | D | A | AD |
21、(1)Mg2+、![]() 、Cl-(3分);
、Cl-(3分); ![]() 、
、![]() (2分); Na+ 、 K+(2分)
(2分); Na+ 、 K+(2分)
(2)可以(1分) 溶液显电中性有阳离子存在必有阴离子存在(2分.其他答案合理给分)
(3)经焰色反应.若显黄色.说明含有Na+. 否则不含Na+.;焰色反应时透过蓝色的钴玻璃观察.若显紫色说明含有K+.否则不含K+.(2分)
22、[答案](1)2NH4Cl+Ca(OH)2![]() 2NH3↑+CaCl2+2H2O。
2NH3↑+CaCl2+2H2O。
(2)NH3+CO2+H2O+NaCl(饱和)
= NaHCO3↓+NH4Cl; 2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(3)“氨碱法”的CO2来源于石灰石煅烧,“联合制碱法”的CO2来源于合成氨工业的废气。
(4)由于总反应可看作是:2NH3+2NaCl+CO2+H2O = Na2CO3+2NH4Cl,所以:
原子利用率(%) =![]() ×100% =
×100% =![]() ×100%;
×100%;
23、[答案](1)检查装置气密性;(2)Cu+4HNO3(浓) = Cu(NO3)2+2NO2↑+2H2O; 反应变缓,气体颜色变淡; (3)丙;耗酸量最少,无污染。 (4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸; c中有黄绿色气体产生,d中溶液变为黄棕色; 没有处理尾气。
24、[答案](1)Cu;Fe(顺序可交换) (3)如下:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量NaOH溶液并滴加到试管A中,充分反应后,静置,弃去上层清液,剩余固体备用。 | 样品部分溶解,并有气体放出。 |
| ② | 往试管A的剩余固体中加过量稀硫酸,充分反应后,静置。取上层清液于试管B中,剩余固体备用 | 固体部分溶解,并有气体放出,溶液呈浅绿色,可能含铁。 |
| ③ | 往试管B中加入少许稀硝酸,再滴加KSCN溶液 | 溶液先变黄色,加KSCN后显血红色,结合②可知,一定含铁。 |
| ④ | 往②剩余固体中加入稀硝酸,再滴加NaOH溶液 | 固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色,加NaOH溶液后有蓝色沉淀产生,一定含铜。 |
25、[答案](1)A:FeS2 C.H2S D.FeCl3 (2)FeS2+2H+=Fe2++H2S↑+S
(3)FeCl2+2NaOH=Fe(OH)2↓+2NaCl; 4Fe(OH)2+O2+2H2O=4Fe(OH)3
26.(1)SiO2+CaCO3![]() CaSiO3+CO2↑;Al2O3+Na2CO3
CaSiO3+CO2↑;Al2O3+Na2CO3![]() 2NaAlO2+CO2↑ (各2分)(2)4FeO·Cr2O3+8Na2CO3+7O2
== 8Na2CrO4+2Fe2O3+8CO2(2分)(3)提取可溶物质,并使AlO2-转化成Al(OH)3(2分) 有关的离子方程是: AlO2-+H++H2O
== Al(OH)3 ¯(2分)
2NaAlO2+CO2↑ (各2分)(2)4FeO·Cr2O3+8Na2CO3+7O2
== 8Na2CrO4+2Fe2O3+8CO2(2分)(3)提取可溶物质,并使AlO2-转化成Al(OH)3(2分) 有关的离子方程是: AlO2-+H++H2O
== Al(OH)3 ¯(2分)
27、(1)2SO2+O2+2H2O = 2H2SO4(或2H2SO3+O2 = 2H2SO4); 2(NH4)2SO3+O2 = 2(NH4)2SO4; 2NH4HSO3+O2 = 2NH4HSO4(任写两个)。 (2)①反应吸热;②(NH4)2SO3·H2O;③防止+4的硫被氧化。 (3)BC。