08届高三化学六校第一次联考试题
化学测试题
总分:100分 考试时间:100分钟 命题人:曹松华 审题人:曹凯 徐建国
相对原子质量:H:1 O:16 Ne:10 S:32 Al:27 Na:23 Cl:35.5 Fe:56 Cu:64 Zn:65
第I卷(选择题,共48分)
一.单选题(每小题只有一个选项符合题意,每小题,共48分)
1.2008年将在我国北京举行夏季奥运会,这次奥运会提出要突出“绿色奥运、科技奥运、人文奥运”的理念,其中绿色奥运是指( )
A.运动员的食品全部是未加任何添加剂的食品
B.所有奥运用品全部是天然绿色植物
C.奥运场馆建设均使用天然材料建造,不使用人工合成材料
D.把环境保护作为奥运设施规划和建设的首要条件
2.下列关于胶体的叙述正确的是( )
A.电泳现象可证明胶体属于电解质溶液
B.胶体中的胶粒可以透过半透膜
C.利用丁达尔效应可以区分溶液和胶体
D.直径介于1~100nm之间的微粒称为胶体
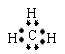 3.下列各种微粒的表示方法中,不正确的是( )
3.下列各种微粒的表示方法中,不正确的是( )
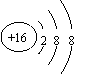 A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
A.甲基的电子式:
B.次氯酸分子的结构式:H—O—Cl
C.硫离子的结构示意图: D.碳-12的原子符号:
![]() C
C
4.在常温常压下呈气态的化合物,降温使其变成固体,得到的晶体属于( )
A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体
5.N2H2是一种高效清洁的火箭燃料,0.25molN2H2(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则下列热化学方程式正确的是( )
A.N2H2(g) + 1/2O2(g) = N2(g) + H2O(g); △H =+133.5kJ/mol
B.N2H2(g) + 1/2O2(g) = N2(g) + H2O(g); △H =-133.5kJ/mol
C.2 N2H2(g) + O2(g) = 2N2(g) + 2H2O(g); △H =+534kJ/mol
D.N2H2(g) + 1/2O2(g) = N2(g) + H2O(g); △H =-534kJ/mol
|
A.P![]() >P
>P![]() ,n>3 B.P
,n>3 B.P![]() <P
<P![]() ,n>3
,n>3
C.P![]() <P
<P![]() ,n<3 D.P
,n<3 D.P![]() >P
>P![]() ,n=3
,n=3
7.实验室里不宜长期放置,应在使用时才配制的试剂是( ) ①酚酞试液 ②银氨溶液 ③Na2CO3溶液 ④Cu(OH)2悬浊液 ⑤FeCl3溶液 ⑥FeSO4溶液 ⑦NaCl溶液 ⑧氯水
A..①③④⑤ B.①②⑤⑦ C. ②④⑥⑧ D.②⑤⑥⑧
8.下列对实验仪器名称的标注或实验操作,正确的是( )
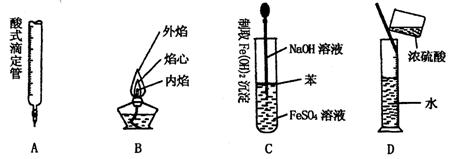
9.为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是( )
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 苯(甲苯) | KMnO4(酸化),NaOH溶液 | 分液 |
| B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
| C | 乙酸乙酯(乙酸) | KOH溶液,水 | 分液 |
| D | 苯(苯酚) | 浓Br2水 | 过滤 |
10.设阿伏加德罗常数的符号为NA,下列叙述正确的是 ( )
A. 18gD2O所含质子数为10 NA
B. 10g氖气所含原子数为2NA
C. 13.5g金属铝与足量盐酸反应转移的电子数为1.5NA
![]() D. 标准状况下,1L辛烷所含的分子数约为1/22.4
NA
D. 标准状况下,1L辛烷所含的分子数约为1/22.4
NA
11.氯水不稳定,因为氯水中存在如下平衡: ,为了提高氯水
稳定性,可采取的措施是( )
A.通入少量H2S气体 B.加入少量小苏打
C.通入少量HCl气体 D.增大氯水浓度
12.常温下,由水电离出的氢离子浓度c(H+)=1×10--13mol/L的溶液中,一定不能大量共存的离子组是( )
A.Cl![]() 、
AlO
、
AlO![]() 、 Na
、 Na![]() 、
K
、
K![]() B.Fe
B.Fe![]() 、
NO
、
NO![]() 、
MnO
、
MnO![]() 、
K
、
K![]()
C.Fe![]() 、
NO
、
NO![]() 、
Ba
、
Ba![]() 、
Cl
、
Cl![]() D.SO
D.SO![]() 、 Na
、 Na![]() 、 Cl
、 Cl![]() 、 K
、 K![]()
13.某种利胆解痉药的有效成分是“亮菌甲素”,其结构简式为
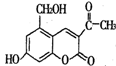 关于“亮菌甲素”的说法中,正确的是( )
关于“亮菌甲素”的说法中,正确的是( )
A.“亮菌甲素”极易溶解于水
B.“亮菌甲素”的分子式为C12H10O5
C.1 mol“亮菌甲素”最多能和4 mol H2发生加成反应
D.1 mol “亮菌甲素”最多能和2 mol NaOH反应
14.下列反应的离子方程式表示正确的是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+ OH- == CO32- + H2O
B.醋酸钠溶液和盐酸混合:CH3COONa + H+ == CH3COOH + Na+
C.少量金属钠放入冷水中:Na+ + 2H2O == Na+ + 2OH— + H2↑
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2+ + SO42- + Ba2+ + 2OH- == Cu(OH)2↓ + BaSO4↓
15.乙醇燃料电池中采用磺酸类质子溶剂,在200℃左右时供电,电池总反应为:
C2H5OH+3O2=2CO2+3H2O,电池示意如图。下列说法中,正确的是( )
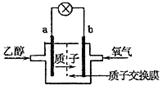 A.电池工作时,质子向电池的负极迁移
A.电池工作时,质子向电池的负极迁移
B.电池工作时,电流由a极沿导线流向b极
C.a极上发生的电极反应是:
C2H5OH+3H2O+12e-=2CO2+12H+
D.b极上发生的电极反应是:4H++O2+4e-=2H2O
16.在某稀溶液中含有0.2molHNO3和0.1molH2SO4,向其中加入12.8g铜粉,充分反应后生成的气体在标准状况下的体积为( )
A.1.68L B.2.24L C.3.36L D.4.48L
第Ⅱ卷(非选择题,共52分)
二、填空题(包括5小题,共45分)
17.(3分)下列实验中所选用的仪器或操作以及结论合理的是
A.用托盘天平称量11.7g氯化钠晶体
B.用碱式滴定管量取25.00mL溴水
C.不宜用瓷坩埚灼烧氢氧化钠、碳酸钠
D.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液,滴在用蒸馏水润湿过的pH试纸上,再与标准比色卡比较
E.仅用蒸馏水和pH试纸作试剂,就可鉴别pH相等的H2SO4和CH3COOH溶液
18.(12分)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2),请写出满足以下要求的四个此类无机化合反应的化学方程式: ①所涉及的元素的原子序数都小于30 ②4种单质分属4个不同族
(1) ;
(2) ;
(3) ;
(4) 。
19.(13分) 下图为某些常见物质之间的转化关系。已知:A、B、I中含有相同的阳离子且都是XY2型化合物,I是常用的干燥剂,C为直线型分子,E、F为气态单质。
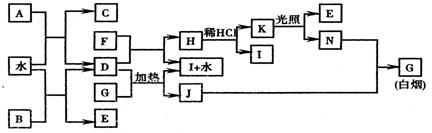
请按要求填空:
(1) B的电子式是 , K的结构式是 ;
(2)A与水反应的化学方程式是 ;
(3)D与G反应的化学方程式是 ;
(4)单质F与D的反应在工业上有重要的用途,其化学方程式是 。
20.(9分)有一种广泛应用于汽车、家电产品上的高分子涂料是按下列流程图生产的。
图中M(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种。
![]()
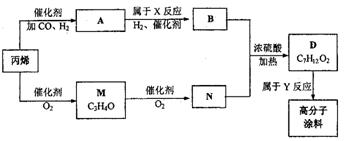
(1)试写出下列物质的结构简式:A M
(2)写出反应N+B→D的化学方程式:
(3)写出反应类型:X ,Y
21.(8分)拟用下图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
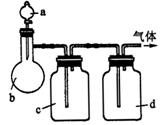
| 气体 | a | b | c | d |
| C | 乙醇 | 浓H | NaOH溶液 | 浓 H |
| NO | 稀HNO | 铜屑 | H | P |
| C | 乙醇 | 浓H | NaOH溶液 | 浓 H |
| NO | 稀HNO | 铜屑 | H | P |
(1)上述方法中可以得到干燥、纯净的气体是 。
(2)指出不能用上述方法制取的气体,并说明理由(可以不填满)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
三、计算题(共1题,7分)
22.向一定量的Fe、FeO、Fe2O3混合物中加入1.00mol/L的盐酸100mL,可恰好使混合物完全溶解, 放出标准状况下224 mL的气体。向所得溶液中加入KSCN溶液,无血红色出现。
(1)若用足量的CO在高温条件下还原相同质量的此混合物,能得到单质铁的质量是多少?
(2)求原混合物中铁元素的质量分数。
 2008届高三六校第一次联考
2008届高三六校第一次联考
一、选择题答题卡(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题(包括5小题,共45分)
17.(3分)_____________________________
18.(共12分,每小题3分)
(1) ;
(2) ;
(3) ;
(4) 。
19.(13分)
(1)______________________________(2分), ______________________(2分)
(2) ;
(3) ;
(4) 。
20. (9分)
(1) A (2分) M (2分)
(2) (3分)
(3) X ,Y (每空1分)
21.(8分)
(1) 。(3分)
(2)(共6分)
①气体 ,理由是 。
②气体 ,理由是 。
③气体 ,理由是 。
④气体 ,理由是 。
三、计算题(7分)
22.
08届高三六校第一次联考化学测试题参考答案
一、选择题答题卡(每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | A | A | D | B | C | C |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | C | C | C | B | D | D | B |
二、填空题(包括5小题,共45分)
17.(3分)A、C、E
18.(每个3分,共12分)(1)2NO + O![]() = 2NO
= 2NO![]() / 2CO + O
/ 2CO + O![]() = 2CO
= 2CO![]() / 2Na
/ 2Na![]() SO
SO![]() + O
+ O![]() = 2Na
= 2Na![]() SO
SO![]()
(2) C +
CO![]() = 2CO(高温条件下) (3) 2FeCl
= 2CO(高温条件下) (3) 2FeCl![]() + Cl
+ Cl![]() = 2FeCl
= 2FeCl![]()
(4) 2FeCl![]() + Fe = 2FeCl
+ Fe = 2FeCl![]()
![]() 19.(1)(每空2分)
19.(1)(每空2分)
(2)(3分)CaC![]() +2H
+2H![]() O→C
O→C![]() H
H![]() ↑+Ca(OH)
↑+Ca(OH)![]()
(3) (3分) ![]()
(4) (3分) 2Ca(OH)![]() +2Cl
+2Cl![]() =CaCl
=CaCl![]() +Ca(ClO)
+Ca(ClO)![]() +2H2O
+2H2O
20.(1) CH3CH2CH2CHO CH2=CHCH
 |
(2) CH3CH2CH2CH2OH+ CH2=CHCOOH CH3CH2CH2CH2OOCCH= CH2+H2O
(3) 加成反应 加聚反应(2+2+3+1+1分,9分)
21.(1) NO (2分)
(2)(每空1分) ① C![]() H
H![]() ,反应液中未插温度计 ② Cl
,反应液中未插温度计 ② Cl![]() ,Cl
,Cl![]() 会与C瓶中的NaOH溶液反应 ③ NH
会与C瓶中的NaOH溶液反应 ③ NH![]() ,NH
,NH![]() 极易溶于C瓶中的水
极易溶于C瓶中的水
六、计算题(包括1小题,共7分)
22.(1) 2.8g(3分) (2)81.4%(4分)
