08届高三化学上学期月考试题
本试卷分为第Ⅰ卷选择题和第Ⅱ卷(非选择题)两部分,共120分。考试时间100分钟.
注意事项:
答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要求填写在答题纸上;非选择题的答案写在答题纸上对应题目的答案空格内,答案不要写在试卷上。考试结束后,交回答题纸。
可能用到的原子量:C 12 O 16 P 31 S 32 Fe 56 Ba 137
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.有关物质燃烧时火焰颜色描述错误的是
A.硫在氧气中燃烧——绿色 B.钠在空气中燃烧——黄色
C.乙醇在空气中燃烧——淡蓝色 D.氢气在氯气中燃烧——苍白色
2.生产、生活离不开各种化学物质,下列说法不正确的是
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用硅制造光导纤维
3.下列说法正确的是
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
C.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
D.天然气、石油和煤均属于可再生能源
4.有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
5.下列各组物质,都能与水反应且生成物都能溶于水的是
A.NO、NO2 B.Na2O2、SO3 C.NH3、Cl2 D.Mg、Al
|
A.可用装置①鉴别碳酸钠和碳酸氢钠 B.可用装置②证明氨气极易溶于水
C.可用装置③从海水中得到淡水 D.可用装置④把胶体从溶液中分离出来
7.金属材料在日常生活以及生产中有着广泛的运用。下列关于金属的一些说法不正确的是
A.工业上金属Mg、Al都是用电解熔融的氯化物制得的
B.合金的性质与其成分金属的性质不完全相同
C.金属冶炼的本质是金属阳离子得到电子变成金属原子
D.越活泼的金属越难冶炼
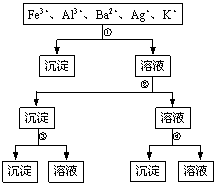 8.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右图所示步骤分开五种离子。则溶液①、②、③、④是
8.用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按右图所示步骤分开五种离子。则溶液①、②、③、④是
A.①NaCl ②NaOH ③NH3·H2O ④H2SO4
B.①NaCl ②NH3·H2O ③NaOH ④H2SO4
C.①H2SO4 ②NaOH ③NH3·H2O ④NaCl
D.①H2SO4 ②NH3·H2O ③NaOH ④NaCl
二、(本题包括8小题,每小题3分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个该小题就为0分)
9.铊(Tl)是某超导材料的组成元素之一,与铝同族,位于第6周期,Tl3+与Ag在酸性介质中发生反应:Tl3+ + 2Ag = Tl+ + 2Ag+ 。下列推断正确的是
A.Tl+ 的最外层有1个电子 B.Tl+ 的还原性比 Ag 强
C.Al3+的氧化性比Tl3+弱 D.Tl只能形成+3价的化合物
10.为了避免青铜器生成铜绿,以下做法正确的是
A.将青铜器保存在干燥的环境中 B.将青铜器放在银质托盘上
C.将青铜器保存在潮湿的空气中 D.在青铜器的表面覆盖一层防渗的高分子膜
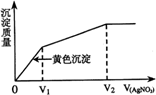 11.往含Cl-和I-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Cl-)/c(I-)的比值为
11.往含Cl-和I-的稀溶液中滴人AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(Cl-)/c(I-)的比值为
A.V1/V2
B.(V2-V1)/V1
C.V1/(V2-V1)
D.V2/V1
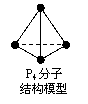 12.阿伏加德罗常数约为6.02×1023
mol-1,下列说法中一定正确的是
12.阿伏加德罗常数约为6.02×1023
mol-1,下列说法中一定正确的是
A.标准状况下,22.4L SO3所含分子数为6.02×1023
B.1L 0.5mol·L-1 CH3COONa溶液中含有的CH3COO-数为
0.5×6.02×1023
C.6.2g白磷P4(右图)中所含的P-P键的个数为0.3×6.02×1023
D.5.6g铁粉与硝酸反应失去的电子数一定为 0.3×6.02×1023
13.下列离子方程式中错误的是
A.用小苏打治疗胃酸过多:HCO3- + H+ = CO2↑+ H2O
B.NH4Al(SO4)2溶液中加入少量氢氧化钠溶液 NH4+ + OH- = NH3·H2O
C.锌片插入硝酸银溶液中 Zn+2Ag+ = Zn2++2Ag
D.将0.1 mol·L-1Ba(OH)2溶液滴入0.1 mol·L-1 KAl(SO4)2至沉淀质量达到最大值
2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
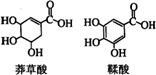 14.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
14.莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量不同
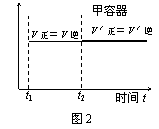
![]() 15.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
15.一定温度下可逆反应:A(s)+2B(g) 2C(g)+D(g) △H<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是


![]()

![]()
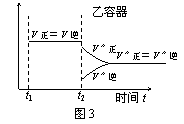

A.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
B.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
C.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
D.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
16.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
⑴第一份加入AgNO3溶液有沉淀产生
⑵第二份加足量NaOH溶液加热后,收集到气体0.04mol
⑶第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.Cl-可能存在 B.Ba2+一定不存在,Mg2+可能存在
C.K+一定存在 D.100mL溶液中含0.01mol CO32-
第Ⅱ卷(非选择题,共72分)
三、(本题包括2小题)
17.(14分)晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
![]() ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000~1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。请回答下列问题:
⑴第①步制备粗硅的化学反应方程式为 。
⑵粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为: 。
⑶用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
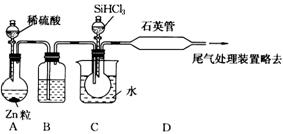
①装置B中的试剂是 ,装置C中的烧瓶需要加热,其目的是: 。
②反应一段时间后,装置D中观察到的现象是 ,装置D不能采用普通玻璃管的原因是 ,装置D中发生反应的化学方程式为 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及 。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
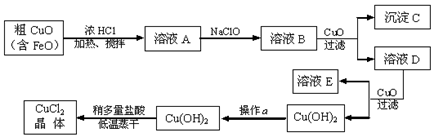 18.(8分)工业上制取CuCl2的生产流程如下:
18.(8分)工业上制取CuCl2的生产流程如下:
请结合下表数据,回答下列问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
⑴溶液A中加入NaClO的目的是 ;
⑵在溶液B中加入CuO的作用是 ;
⑶操作a的目的是 ;
⑷在Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2过程中,采取稍多量盐酸和低温蒸干措施的目的是 。
四、(本题包括2小题)
19.(8分)在加热条件下发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行 测定,测得如下数据:
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 40.0 | 2.3 | 37.8 | 0.0 |
| 反应后质量/g | 43.6 | 待测数据 | 12.6 | 3.2 |
请回答下列问题:
(1)(4分)上表中“待测数据”的数值是多少_______,此密闭容器内发生的反应属于______________(填基本反应类型)。
(2)(4分)若X是水,Y是氮的氧化物,且反应式的计量系数比是n(X):n(Y):n(Z):n(Q)=2:4:4:1,则该反应的化学方程式为____________________________。
20.(12分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A是具有刺激性气味的气体,I是由地壳中含量最高的金属元素形成的单质,K是一种红棕色气体,D是一种红棕色粉末,常用作红色油漆和涂料。
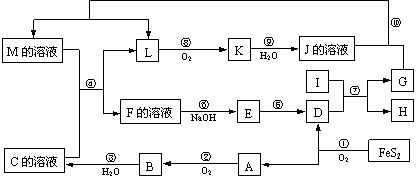 |
请填写下列空白:
⑴在周期表中,组成单质G的元素位于第______周期______族。
⑵在反应⑨中还原剂与氧化剂的物质的量之比为___________________。
⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是_________(填写序号)。
⑷反应④的离子方程式是:_______________________________________。
⑸将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。该反应的化学方程式是:_____________________。
五、(本题包括2小题)
21.(7分)到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源。
⑴化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= kJ·mol-1;
⑵已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-25kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
22.(13分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
![]()
⑴配平上述反应的化学方程式(将化学计量数填在方框内)并用单线桥法表示电子转移的方向和数目;
⑵该反应的氧化剂是 ,其还原产物是 ;
⑶该反应的平衡常数表达式为K= ;
⑷若知上述反应为放热反应,则其反应热△H 零(填“>”、“<”或“=”;升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
⑸若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
⑹若已知CO生成速率为v(CO)=18mol/(L·min),则N2消耗速速率为v(N2)= mol/(L·min)。
六、(10分)
23-A.酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:
 CH3COOH+C2H5OH
CH3COOH+C2H5OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有 、
等。
(2) 若用右图所示装置来制备少量的乙酸乙酯,产率往往偏低,
其原因可能为 、
等。
(3)此反应以浓硫酸为催化剂,可能会造成 、 等问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,
且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
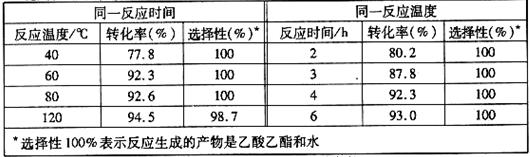
①根据表中数据,下列 (填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h C.60℃,4h D.40℃,3h
② 当反应温度达到120℃时,反应选择性降低的原因可能为
 高三第二次月考化学试题答题纸
高三第二次月考化学试题答题纸
| 注意事项 | 1. 答题前,考生将自己的姓名、考场、考号填写清楚,并认真核对姓名、考号及科目。 2. 在草稿纸、试题卷上答题无效。 3. 保持字体工整,笔迹清晰,卡面清洁,不折叠。 |
| 选择题(涂卡) |
| |||||||||||||||||||||||||||||||||||||
| 非 选择题 | 答题说明:除作图可使用2B铅笔外,其余各题请按题号用0.5mm黑色签字笔书写,否则作答无效。 | |||||||||||||||||||||||||||||||||||||
| 17.⑴ 。⑵ 。 ⑶① , 。 ② , , 。 ③ 。 ④ 。 18.⑴ ; ⑵ ; ⑶ ; ⑷ 。 19.⑴ , ;⑵ ; 20.⑴第___ ___周期__ ____族。⑵之比为___________________。 ⑶__ __ __ ___。⑷ 。 ⑸____________________________________________________________。 | ||||||||||||||||||||||||||||||||||||||
| 请在各题规定的区域内答题,超出该区域的答案无效! | ||||||||||||||||||||||||||||||||||||||
| 21.⑴E(H-Cl)= ; ⑵ ;
⑵ , ; ⑶K= ;⑷△H 零; ⑸ ⑹v(N2)= mol/(L·min)。 23-A.⑴ , 。 ⑵ , 。 ⑶ , 。 ⑷① ;② 。 | ||||||||||||||||||||||||||||||||||||||
| 请在各题规定的区域内答题,超出该区域的答案无效! | ||||||||||||||||||||||||||||||||||||||
高三化学月考4参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | C | B | C | D | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | AD | B | C | BD | A | B | AC |
![]()
17.⑴ ⑵蒸馏 ⑶①浓硫酸 使滴入烧瓶中的SiHCl3汽化
![]() ②有固体物质生成 在反应温度下,普通玻璃会软化
②有固体物质生成 在反应温度下,普通玻璃会软化
③排尽装置中的空气(其它合理答案也可酌情给分)。 ④bd
18.⑴将Fe2+氧化为Fe3+而使分离更加完全
⑵调节溶液的pH为3~4,使Fe3+完全转变为Fe(OH)3沉淀而分离Fe3+
⑶洗涤Cu(OH)2表面的可溶性杂质
⑷抑制Cu2+的水解
19.(1)20.7 分解反应 (2)4HNO3 ![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
20.⑴四 Ⅷ ⑵2:1 ⑶②⑧
⑷3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO↑+ 2H2O
⑸Fe2O3 + 3KNO3 + 4KOH = 2K2FeO4 + 3KNO2 + 2H2O
21.⑴434
![]() ⑵FeO(s) + CO(g)=Fe(s) + CO2(g)
△H=-11 kJ·mol-1
⑵FeO(s) + CO(g)=Fe(s) + CO2(g)
△H=-11 kJ·mol-1
22.⑴3,6,2,1,6 ⑵N2,Si3N4 ⑶
⑷<;减小 ⑸逆 ⑹6
23.
(l)增大乙醇的浓度 移去生成物
(2)原料来不及反应就被蒸出 温度过高,发生了副反应 冷凝效果不好,部分产物挥发了
(任填两种)
(3)产生大量的酸性废液(或造成环境污染) 部分原料炭化 催化剂重复使用困难催化效果不理想(任填两种)
(4)① C ②乙醇脱水生成了乙醚