08届高三化学上学期期末联考试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ试卷共8页,有22小题,满分为100分,考试时间90分钟。
2.本卷答案必须写在答题卡的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、分别填写在答题卡的相应位置上。考试结束后只需上交答题卡,考试时不能使用计算器。
4.本卷可能用到的相对原子质量: H:1 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 Fe:56 Cu:64 Zn:65
★ 祝同学们考试顺利 ★
第Ⅰ卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
![]() 1.下列化学用语表达正确的是
1.下列化学用语表达正确的是
A.丙烷的分子结构模型示意图:
![]() B.Na2S的电子式:
B.Na2S的电子式:
C.丙烯的结构简式:CH3CH2CH2
D.氢硫酸的电离方程式:H2S+H2O=H3O++HS-
2.下列说法正确的是:
A.H与D,16O2与18O2互为同位素
B.H216O、D216O、H218O、D218O互为同素异形体
C.在NaCl晶体中,每个氯离子周围都有8个钠离子
D.L层电子为奇数的所有短周期元素所在族的序数与该元素原子的L层电子数相等
3.下列现象或应用中,不涉及胶体性质的是
A. 在饱和的氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀
B. 清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱
C.用半透膜分离淀粉和食盐的混合液
D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
4.某温度下,重水(D2O)的离子积常数为1.6×10-15 若用定义pH一样来规定pD=-lg[D+ ],则在该温度下,下列叙述正确的是( )。
A.纯净的重水中,pD=7
B.1 L溶解有0.01 mol DC1的重水溶液,其pD=2
C.1 L溶解有0.01 mol NaOD的重水溶液,其pD=12
D.纯净的重水中, [D+ ][OD- ]>1.0×10-1 4
5.化学家们合成了如下图所示的一系列的星烷,如三星烷、四星烷、五星烷等。
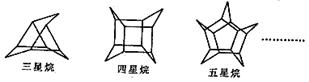 下列说法正确的是
下列说法正确的是
A.它们的一氯代物均只有三种
B.它们之间互为同系物
C.三星烷与乙苯互为同分异构体
D.六星烷的化学式为C18H24
6.用右图表示的一些物质或概念间的从属关系中不正确的是
| X | Y |
| |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯的同系物 | 芳香烃 | 芳香族化合物 |
| B | 胶体 | 分散系 | 混合物 |
| C | 电解质 | 离子化合物 | 化合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |
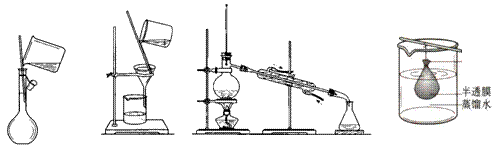 7.以下实验装置一般不用于分离物质的是
7.以下实验装置一般不用于分离物质的是
A. B. C. D.
8.对于Al与重氢氧化钠(NaOD)的水溶液反应,下列说法正确的是
A.生成的氢气中只含有D2 B.生成的氢气中含有H2、HD、D2
C.生成的氢气中只含有H2 D.以上判断都不正确
9.恒温下,容积均为2L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应 3A(g) + 2B(g) ![]() 2C(g) + xD(s) 的化学平衡状态,相关数据如下:M: 3molA
2molB; 2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin.N: 2molC ymolD; 达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
2C(g) + xD(s) 的化学平衡状态,相关数据如下:M: 3molA
2molB; 2min达到平衡,生成D1.2mol,测得从反应开始到平衡C的速率为0.3mol/Lmin.N: 2molC ymolD; 达到平衡时c(A)=0.6mol/L。下列推断的结论中不正确的是
A.x=2 B.平衡时M中c(A)=0.6mol/L
C.y﹥0.8 D.y=2
10.下列离子方程式书写正确的是
A.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+
B、Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:Ca2+ + OH- + HCO3- = CaCO3 ↓+ H2O
C.用铂电极电解硫酸铜溶液 2Cu2++4OH-![]() 2Cu+O2↑+2H2O
2Cu+O2↑+2H2O
D、FeI2溶液中通入少量Cl2:2Fe2+ + Cl2 = 2 Fe3+ + 2Cl-
11.下列各溶液中,各离子可能大量共存的有
A.含有大量Ba2+的溶液中:HCO3-、Fe3+、Ag+、SO42-、SCN-
B.由水电离的c(OH-)=10-14mol·L-1 的溶液中:CH3COO-、 C6H5O-、Na+、K+
C.滴加无色酚酞试液后仍无色的溶液中:Na+、CO32-、K+、ClO-、AlO2-
D.加入铝粉后产生氢气的溶液中:NH4+、Na+、NO3-、Cl-、S2-
12.NA表示阿佛加德罗常数,下列说法正确的是( )
A.常温下,1L0.1mol·L-1CH3COOH溶液中含CH3COO-数为0.1NA.......
B.标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA
C.含1mol硅原子的SiO2晶体中Si-O键的个数为NA
D.分解H2O2制O2,每生成1molO2转移4NA个电子
13.将两个铂电极插入KOH溶液中,向两极分别通入CH4和O2,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应为:CH4 +10OH- -8e- = CO32- + 7H2O ;下列叙述正确的是
A、通入甲烷的一极为正极
B、通入氧气的一极发生氧化反应
C、该电池总反应为:CH4 + 2O2+ 2OH- = CO32- + 3H2O
D、该电池在工作时,溶液中的阴离子向正极移动
14.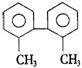 已知C—C键可以绕键轴自由旋转,结构简式为
的烃,下列说法中正确的是
已知C—C键可以绕键轴自由旋转,结构简式为
的烃,下列说法中正确的是
A.分子中至少有8个碳原子处于同一平面上
B.分子中至少有9个碳原子处于同一平面上
C.该烃的一氯取代物最多有四种
D.该烃是苯的同系物
15. 0.1mol/L的NaOH溶液0.2L,通入448mL(S.T.P.)H2S气体,所得溶液离子浓度大小关系正确的是
A.c(Na+)>c(HS-)>c(OH-)>c(H2S)>c(S2-)>c(H+)
B.c(Na+)+ c(H+)= c(HS-)+c(S2-)+c(OH-)
C.c(Na+)=c(H2S)+c(HS-)+c(S2-)+c(OH-)
D.c(S2-)+c(OH-)=c(H+)+c(H2S)
16.现有100 mL 溶质为MgCl2和AlCl3的混合溶液,其中c(Cl-)=1.0 mol·L-1,c(Mg2+)=0.2mol·L-1。若不考虑水解因素,则要使其中的Mg2+全部转化为Mg(OH)2沉淀而分离出来,至少需要4mol·L-1的NaOH溶液的体积是
A.25mL B.5mL C.30mL D.100mL
答题卡
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括2小题,共14分)
17.(10分)某同学为研究硝酸与镁的反应,进行图示实验,实验现象及相关数据如下:(a)A中为一定浓度的硝酸与Mg片发生反应,生成的气体通过B后,在B中只生成一种盐,剩余气体遇空气不变色,其体积为原体积的一半。(b)从C进入D中的气体有两种,且体积比为1∶1。(c)将D加热一段时间后,E中干燥的红色石蕊试纸逐渐恋蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
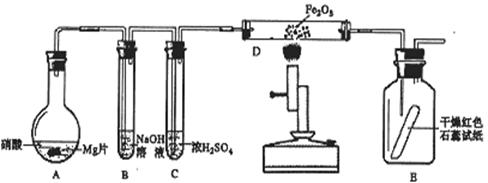
⑴硝酸与Mg片反应生成的气体成分是___________________(用化学式表示)。
⑵硝酸在装置A的反应中所表现的性质有___________________________。
⑶写出D中发生反应的化学方程式_______________________________________。
⑷若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的1/4(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式______________________________________________________。
18.(4分)下列实验操作正确的是 。
A. 使用冷凝管时,应使冷却液与被冷却的物质流动方向相同;
B. 盛过苯酚的试管可以用NaOH溶液清洗,若皮肤上沾有苯酚,应立即用酒 精洗涤;
C. 用3%的硫酸和无水乙醇加热至170℃,可以制取乙烯;
D.除去苯中的少量苯酚,可加入适量的浓溴水后再过滤;
E. 分馏原油实验中,温度计的下端不插入原油中;
F. 碳化钙是块状固体,但实验室中不用启普发生器制乙炔;
G.将苯与溴水混合后加铁屑可制取溴苯;
H. 将溴乙烷与NaOH溶液共热几分钟后冷却,滴入AgNO3溶液,观察沉淀颜色,可用来检验溴乙烷中溴元素的存在。
三、填空题(本题包括3小题,共30分)
19. (8分)今有一混合物的水溶液,只可能含有以下离子中的若干种: K+、 NH4+、
Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,确定一定存在的离子是 ;可能存在的离子是 ;一定不存在的离子是
。
20.(10分)根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
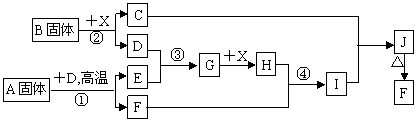 |
(1)G的化学式为 ;
(2)固体A中所包含的化学键与固体B类似,则A的电子式为 ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
![]() 21.(14分)已知:C2H5OH+HO—NO2(硝酸)
C2H5O—NO2(硝酸乙酯)+H2O
21.(14分)已知:C2H5OH+HO—NO2(硝酸)
C2H5O—NO2(硝酸乙酯)+H2O
|
![]() RCH(OH)2 RCHO+H2O
RCH(OH)2 RCHO+H2O
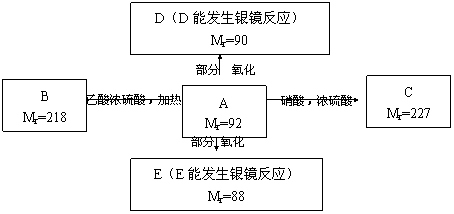
现有只含C、H、O的化合物A、B、D、E,其中A为饱和多元醇,其它有关信息已注明在下图的方框内。
回答下列问题:
(1)A的分子式为 ;
(2)写出下列物质的结构简式:
B ;E ;
(3)写出下列反应的化学方程式和反应类型:
A→C: ,反应类型: ;
A→D: ,反应类型: ;
(4)工业上可通过油脂的皂化反应得到A,分离皂化反应产物的基本操作是 。
 |
四、计算题(本题包括1小题,共8分)
22.(8分)400K、1.01×105 Pa时,2 L烃A的蒸气能在V L氧气中完全燃烧,反应后体积增至(V+4) L(体积在同前的条件下测定)。请回答:
(1) 烃A在组成上应满足的条件是 。
(2) 当V=15时,该烃可能的分子式为 。
(3) 若A在常温常压下为气态,V的取值范围是 。
参考答案
第Ⅰ 卷(选择题,共48分)
一、选择题(每题只有一个选项符合要求, 每小题3分,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | A | B | D | C | A | B |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | D | B | B | B | C | B | D | C |
第Ⅱ卷(非选择题,共52分)
二、实验题(本题包括2小题,共14分)
17.(10分) 答案:
⑴NO NO2 N2 H2 (2分)
|
|
|
⑷12Mg+30H++5NO3-=12Mg2++NH4++NO2↑+NO↑+N2↑+H2↑+12H2O(2分)
18.(4分)答案:
B E F;
三、填空题(本题包括3小题,共30分)
19.(6分) 答案:
一定存在NH4+ 、K+ 、CO32-、SO42- ;(2分)可能存在Cl-; (2分) 一定不存在Ba2+、Mg2+(2分)
20.(10分)答案:
|
|
|
|
(3)2Na2O2+2H2O=4Na++4OH-+O2↑(2分)
(4)Fe2O3+6H+=2Fe3++3H2O (2分)
(5)4FeS2(S)+11O2(g)=2Fe2O3(S)+8SO2(g);△H=-3408 kJ·mol-1(2分)
21.(共14分)答案:
(1)C3H8O3…………2分
![]()
![]()
![]() (2)CH2O—C—CH3 ; CHO各2分
(2)CH2O—C—CH3 ; CHO各2分
![]()
![]()
![]() CHO—C—CH3 CHOH
CHO—C—CH3 CHOH
CH2O—C—CH3 CHO
![]()
![]() CH2OH
CH2ONO2
CH2OH
CH2ONO2
![]()
|
CH2OH CH2ONO2
![]()
![]() CH2OH
CHO
CH2OH
CHO
|
|
CH2OH CH2OH
(4)盐析,过滤………………各1分
四、计算题(本题包括1小题,共8分)
22.(共8分)答案:
(1)烃分子中氢原子数为8;(3分)
(2)C3H8、C4H8、C5H8;(3分)
(3)≥12(2分)。
 Z
Z