08届高三化学下期中考试试卷
高三化学
本卷可能用到的相对原子质量数据:
H-1 C-12 N-14 O-16 Al-27 Cl-35.5 K-39 Fe-56 Cu-64
一、选择题(本题有23小题,每题只有一个正确选项,共46分)
1.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
2. 咖喱是一种烹任辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄色污渍变为红色。经水漂洗后红色又变为黄色。据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用
A 品红溶液 B 石蕊溶液 C 氯水 D KI一淀粉溶液
3.环境污染问题越来越受到人们的关注,造成环境污染的主要原因大多是由于人类生产活动中过度排放有关物质引起的。下列环境问题与所对应的物质不相关的是
A.温室效应——二氧化碳 B.光化学污染——二氧化氮
C.酸雨——二氧化碳 D.臭氧层破坏——氟氯烃
4.下列物质的俗名与其化学式不相对应的是
A.小苏打一Na2 CO3·10H2O B.生石膏一CaSO4·2H2O
 C.石英-SiO2 D.重晶石一BaSO4
C.石英-SiO2 D.重晶石一BaSO4
5.C60分子结构 与足球 形状相似,它与金刚石 互为
A.同位素 B.同分异构体 C.同素异形体 D.同种物质
6、下列反应的离子方程式书写不正确的是
A、在氢氧化钙溶液中加入过量小苏打:Ca2++2OH-+2HCO3-= CaCO3↓+2H2O+CO32-
B、在氢氧化钾稀溶液中通过量的二氧化硫气体:SO2+OH- = HSO-3
C、过量的铁与稀硝酸反应:3Fe+8H++2NO-3 = 3Fe2++2NO↑+4H2O
D、Fe2O3溶于过量的氢碘酸溶液中:Fe2O3+6H+ = 2Fe3++3H2O
7.设NA表示阿伏加德罗常数,下列说法中不正确的是
A.22g二氧化碳中含有的共用电子对数目为2NA
B. 125gCuSO4·5H2O晶体中含有0.5NA个Cu2+
C.0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D. 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
![]()
![]()
![]() 8.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
8.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是
![]()
![]() A.C
CO
CO2
Na2CO3
A.C
CO
CO2
Na2CO3
![]()
![]() B.Cu
Cu(NO3)2溶液
Cu(OH)2
B.Cu
Cu(NO3)2溶液
Cu(OH)2
![]()
![]() C.Fe
Fe2O3
Fe2(SO4)3溶液
C.Fe
Fe2O3
Fe2(SO4)3溶液
D.CaO Ca(OH)2溶液 NaOH溶液
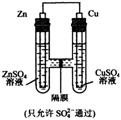 9、如图所示,下列叙述不正确的是
9、如图所示,下列叙述不正确的是
A、该装置是原电池
B、硫酸根离子从右流向左
C、锌为负极,发生还原反应
D、铜棒的质量会增重
10.下列各组离子一定能大量共存的是
A.含大量Fe3+溶液中:NH4+、Na+、Cl—、SCN—
B.在强碱性溶液中:Na+、K+、AlO2—、CO32—
C.在c(H+)=10-12 mol/L溶液中:NH4+、Al3+、SO42—、NO3—
D.常温时,在pH=1的溶液中:K+、Fe2+、Cl—、NO3—
11.煤的气化是煤高效、洁净利用的方向之一。下图为加热某地煤样所得煤气组成及体积分数随温度变化的曲线图。由图可知该煤气中
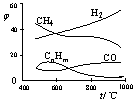
A、只含有碳、氢两种元素 B、所含的有机物是CH4、CnHm、CO
C、CO体积分数小于CH4体积分数 D、氢气体积分数最大
12、工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2。为了便于监控,实施环境保护,下列适合测定硫酸尾气SO2含量的是
A、品红溶液 B、氨水、酚酞试液
C、碘水、淀粉溶液 D、以上都能
13.已知反应mA(g)+nB(g)![]() qD(g)的△H<0,m+n>q,在一个固定密闭容器中反应达到平衡时,下列说法正确的是
qD(g)的△H<0,m+n>q,在一个固定密闭容器中反应达到平衡时,下列说法正确的是
A.增加A的质量,B的转化率降低
B.降低温度,混合气体的平均相对分子质量变小
C.通入稀有气体,使压强增大,平衡向正反应方向移动
D.B的正反应速率是A的逆反应速率的n/m
14. 常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a>b>c
C、同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
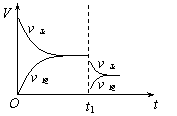 15.在密闭容器中进行2SO2+O2
15.在密闭容器中进行2SO2+O2![]() 2SO3(g)(正反应放热)。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
2SO3(g)(正反应放热)。右图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
16. 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
17.常温下,测得某氨水溶液的pH 约为12,将其与0.01 mol/L的盐酸等体积混合后,所得溶液中物质的量浓度最大的离子是
A. Cl- B. NH4+ C. H+ D. OH-
18、在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、![]() 、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有
、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括K+和OH-)有
A、4种 B、5种 C、6种 D、7种
19.20℃时,KCl的溶解度为34g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl溶液的物质的量浓度不可能是
A.5mol/L B.4mol/L C.3mol/L D.2mol/L
20.医疗上颇为流行的“理疗特效垫”,就是利用铁缓慢氧化放出的热均匀、稳定,使患处保持温热状态。56g铁粉被完全氧化,需消耗氧气的质量为
A.16g B.21g C.24g D.32g
21.将5.4g Al投入200.0mL 1.0mol∙L-1 的某溶液中放出氢气,充分反应后无固体物质剩余。该溶液可能为
A.HNO3溶液 B.Ba(OH)2溶液 C.H2SO4溶液 D.HCl溶液
22.有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl—离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
23.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是
A.若金属有剩余,在溶液中再滴入硫酸后,金属不会溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
二、推断题:(19分)
24.(11分)有A、B、C、D、E、F六种元素,原子序数依次增大,位于不同的三个短周期,其中B与D可形成DB2、DB3化合物,在同周期元素中,C的金属性最强,E的非金属性最强;请回答:
(1)写出A、C、E三种元素的名称
A. C. E.
(2)A、B形成的化合物与DB2反应生成一种强酸的化学方程式为:
(3)已知DB2在一定条件下可转化为DB3,1mol DB2充分反应,放出98.3kJ的热量。该反应的热化学方程式是
(4)用铂作电极电解由C、E形成化合物的饱和溶液时,一段时间后,将阳极产物和阴极溶液混合,反应的离子方程式是 。若改用铁棒做阳极材料,则阳极的电极反应式为: 。
25.(8分) a单质及其化合物在一定条件下可发生如右图所示的
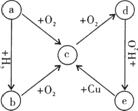 变化,五种物质中都含有同一种元素。
变化,五种物质中都含有同一种元素。
(1)若a常温下是一种固体,则a是 ,c是 。
e→c的化学方程式为 。
(2)若a常温下是一种气体,则a是 ,d是 。
e→c的离子方程式为 。
三、填空题:(20分)
26.(8分)有一包黑色物质为氧化铜和氧化亚铁的混合物。实验小组欲利用该黑色粉末制取较纯净的硫酸铜,通过查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+ 、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3。实验小组设计了如下实验方案:
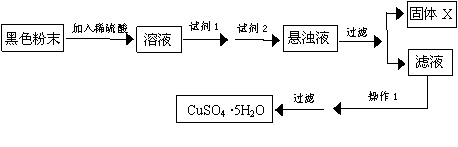
![]()
试回答:试剂1为 ,试剂2为 (填字母),固体X的化学式是 ;
操作1的名称为 。
27.(12分)Ⅰ.A、B两种金属元素在周期表中位于同一周期,A位于mA族,B位于nA族,等物质的量浓度AClm溶液的pH比BCln溶液大,则原子半径rA rB(填“>”或 “<”),理由是
Ⅱ.已知某无色溶液中只含有包括Na+、CH3COO-在内的四种离子,请回答下列问题:
(1)若该溶液中只含有一种溶质,则该溶液显 性,相关的离子方程式为 。
(2)若该溶液呈酸性,则溶液中的溶质为 。
(3)若溶液中含有两种溶质,且溶液呈碱性,则该溶液中不可能出现的离子浓度大小关系是 。(选填编号字母)
(A)c(CH3COO-)> c(Na+) (B)c(Na+)>c(CH3COO-) (C)c(Na+) > c(OH-)
(D)c(OH-)> c(Na+) (E)c(OH-)> c(CH3COO-) (F)c(CH3COO-)> c(OH-)
四、实验题:(15分)
28.某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1-2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
① 甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含___________(填粒子符号)所致。
② 乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_____________(填粒子符号)所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液;b.CCl4; c.无水酒精;d. KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)结论
氧化性:Br2>Fe3+。故在足量的稀氯化亚铁溶液中,加入1-2滴溴水,溶液呈黄色所发生的离子反应方程式为______________________________。
(5)实验后的思考
① 根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______。
② 在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量的浓度为_______________。
期中考试答题卷
高三化学
一.选择题:(唯一选项,共46分)
在答题卡上填涂
二、推断题:(19分)
24.(11分)(1)A. C. E.
(2)
(3)
(4) 。 。
25.(8分)
(1) , 。 。
(2) , 。 。
三、填空题:(20分)
26.(8分)
![]() 1为
, 2为 ,X是 ;名称为
。
1为
, 2为 ,X是 ;名称为
。
27.(12分)
Ⅰ. rA rB,理由是
Ⅱ. (1) ,相关的离子方程式为 。
(2) 。
(3) 。
四、实验题:(15分)
28. ①___________,②_____________。
(3)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)______________________ ________。
(5)①___ ____。②_________ _____。
参考答案及评分标准
高三化学
一.选择题:(唯一选项,共46分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | B | B | C | A | C | D | D | D | C | B | C | C |
| 题号 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | |
| 答案 | D | A | C | C | B | B | A | C | B | D | D |
二、推断题:(19分)
24.(11分)(1)A. 氢 C. 钠 E. 氯
(2) H2O2+SO2 === H2SO4
(3) 2SO2(g) + O2(g) === 2SO3(g); △H=-196.6KJ/mol
(4) Cl2 + 2OH- === Cl- + ClO- + H2O 。 Fe -2e- === Fe2+ 。
25.(8分)
(1) S , SO2 。 Cu+2H2SO4===CuSO4+SO2↑+2H2O。
(2) N2 , NO2 。 3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O 。
三、填空题:(20分)
26.(8分)
![]() 1为 B , 2为 D ,X是 Fe(OH)3 ;名称为 蒸发冷却结晶 。
1为 B , 2为 D ,X是 Fe(OH)3 ;名称为 蒸发冷却结晶 。
27.(12分)
Ⅰ. rA > rB,理由是AClm溶液pH比BCln大,说明Am+比Bn+水解程度小,所以A的金属性比B强,在周期表中A应位于B的左侧,所以A的半径大于B
Ⅱ. (1) 碱 ,相关的离子方程式为 CH3COO-+H2O=== CH3COOH+OH- 。
(2) CH3COOH 和 CH3COONa 。
(3) A、D 。
四、实验题:(15分)
28. ①__Br2__,②___Fe3+___。
(3)
| 选用试剂 | 实验现象 | |
| 方案1 | b | CCl4层无色 |
| 方案2 | d | 溶液有红色出现 |
(4)_Br2 +2Fe2+===2Fe3+ + 2Br-__。
(5)①__Fe2+__。②__1mol/L__。