08届高三化学上册第一次调研测试试题
本试卷分为第Ⅰ卷选择题和第Ⅱ卷(非选择题)两部分,共120分。考试时间100分钟.
注意事项:
答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要求填涂在答题纸上;非选择题的答案写在答题纸上对应题目的答案空格内,答案不要写在试卷上。考试结束后,交回答题纸。可能用到的相对原子质量:
H:1 C:12 N:14 O:16 S:32 Cl:35.5 Na:23 Al:27 Ca:40 Fe:56Cu:64
第Ⅰ卷(共48分)
一、单项选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
1.2007年3月22日是第十五届“世界水日”。我国纪念“世界水日”和开展“中国水周”活动的宣传主题为“水利发展与和谐社会”。下列有关活动不符合这一主题的是
A.大力提倡全民节约用水,加强城市生活污水处理,坚持达标排放
B.加强工业用水净化系统工程的改造,提高水的重复利用率
C.加快产业结构调整,建立水资源节约型、环保型的国民经济体系
D.大力推广使用纯净水代替自来水作生活用水,以保障用水安全
2.金属钛对体液无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关![]() 的说法中正确的是
的说法中正确的是
A.![]() 原子中均含有22个中子
原子中均含有22个中子
B.![]() 在周期表中位置相同,都在第4纵行
在周期表中位置相同,都在第4纵行
C.分别由![]() 组成的金属钛单质互称为同分异构体
组成的金属钛单质互称为同分异构体
D.![]() 为同一核素
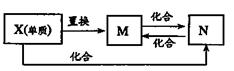
为同一核素
3.氯气是一种重要的工业原料。工业上利用反应3Cl2 + 2NH3 = N2 + 6HCl检查氯气管道是否漏气。下列说法错误的是
A.若管道漏气遇氨就会产生白烟; B.该反应利用了Cl2的强氧化性
C.该反应属于复分解反应; D.生成1molN2有6mol电子转移
4. 化学实验设计和操作中必须十分重视科学性、安全性和环境保护。下列实验中处理方法不正确的是
① 配制一定体积一定物质的量浓度溶液时,定容后“盖好瓶塞,反复上下颠倒,摇匀。”发现凹液面低于刻度线,不再加水补齐。
② 探究氯气性质时,为保证现象明显,氯气应过量。
③ 为除去溶液中的杂质离子,所加除杂试剂应过量。
④ 金属钠等活泼金属不慎着火,立即用干燥的沙土扑灭。
⑤ 制取硝酸铜的最佳方案是以铜和浓硝酸直接反应。
⑥ 稀释浓硫酸时,可先在烧杯中加一定体积的水,再边搅拌边沿玻棒缓缓加入浓硫酸
A. ①② B. ②⑤ C.③⑥ D. ④⑤
5.用NA表示阿伏加德罗常数,下列说法正确的是
A.71g氯气与过量的铁粉完全反应转移的电子数为3NA
B.1 molSiO2晶体中含有共价键的数目是4NA
C.标准状况下,2.24L三氧化硫所含的分子数为0.1NA
D.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
6.世界著名的科技史专家、英国剑桥大学的李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是
A.制普通玻璃的原料主要是纯碱、石灰石和石英
B.玻璃在加热熔化时有固定的熔点
C.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅
D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口粘在一起
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢。以下关于PH3的叙述正确的是
A.PH3分子中有未共用电子对(孤对电子) B.PH3是非极性分子
C.它的分子构型是平面三角形 D.磷原子采用sp2杂化方式
8.向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成是:
A.NaCl NaBr Na2SO4 B.NaCl Na2SO4
C.NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
二、不定项选择题(本题包括8小题,每小题3分,共24分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
14.下列反应的离子方程式书写正确的是
A.过氧化钠固体与水反应:2O22—+2H2O=4OH-+O2↑
B.氨水中通入过量二氧化硫:2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
C.以FeCl3溶液腐蚀印刷电路版:Fe3++Cu=Fe2++Cu2+
D.将2mol/LAlCl3溶液和7mol/LNaOH溶液等体积混合:2Al3++7OH-=Al(OH)3↓+AlO2-+2H2O
|
A.Fe B.Cu
C.N D.C
11、下列过程中,最终的白色沉淀不一定是BaSO4的是
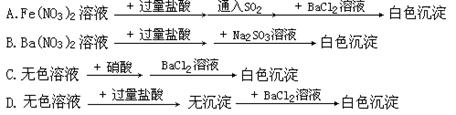 |
 12.下列实验操作安全正确的是
12.下列实验操作安全正确的是
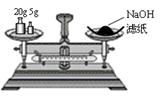
A.称量氢氧化钠固体 B.配制150mL0.10mol/L盐酸
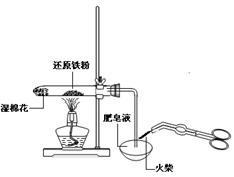
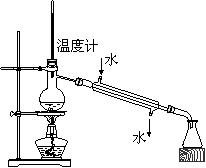
C.检验铁粉与水蒸气反应产生的氢气 D.分离两种互溶但沸点相差较大的液体混合物
13.一定能在下列溶液中大量共存的离子组是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.pH为1的盐酸溶液:Ca2+、Na+、Mg2+、NO3-
C.与铝反应放出氢气的溶液:K+、SO42-、Br-、Na+
D.亚硫酸钠溶液:K+、SO42-、NO3-、H+
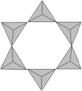 14.1798年法国化学家对绿柱石和祖母绿进行化学分析发现了铍。已知绿柱石是一种呈绿色的硅酸盐,可表
14.1798年法国化学家对绿柱石和祖母绿进行化学分析发现了铍。已知绿柱石是一种呈绿色的硅酸盐,可表
![]() 示为BexAly[SimOn](x、y、m、n均为自然数),其中阴离子部分结构如下图所示(已知 表示硅酸根离
示为BexAly[SimOn](x、y、m、n均为自然数),其中阴离子部分结构如下图所示(已知 表示硅酸根离
子SiO44—),下列说法肯定不正确的是
A. 阴离子化学式为:Si6O1612—
B. 绿柱石可用氧化物形式表示为:3BeO·Al2O3·6SiO2
C. 绿柱石可表示为Be3Al2[Si3O12]
D. 绿柱石可溶于强碱和氢氟酸
15.已知:X、Y是同周期的主族元素,且电负性X>Y,下列说法错误的是:
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的酸性
D.气态氢化物的稳定性:HmY小于HmX
16.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则下列判断正确的是
A.反应过程中得到6.72L(标准状况)的气体 B.最终得到7.8g的沉淀
C.最终得到的溶液中c(NaCl)=1.5mo/L D.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
第Ⅱ卷(共72分)
三、(本小题包括2小题,共20分)
17.(8分)在足量的稀氯化亚铁溶液中加入1~2滴液溴,振荡后溶液变为黄色。
(1)甲同学认为是Br2溶于水变成黄色溶液 ; 乙认为是Fe2+被氧化成Fe3+使溶液变成黄色。
(2)现提供试剂:
A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氯化碳 D.硫氰化钾溶液
请判断 (填“甲”或“乙”)的推断正确,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象:
|
| 选用试剂 | 实验现象 |
| 第一种方法 |
|
|
| 第二种方法 |
|
|
(3)若选用淀粉碘化钾溶液判断哪位同学的推断正确,是否可行?(填“可行”或“不可行”): ;理由: ;
18.(12分)铜及其化合物一般都具有特征的颜色,例如Cu、Cu2O呈红色,CuO呈黑色,CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室的Cu2O试样中是否含有Cu进行了认真的探究。
Ⅰ.查阅资料:①Cu2O属于碱性氧化物; ②在空气中灼烧Cu2O生成CuO;③Cu2O在酸性条件下能发生自身氧化还原反应(Cu2O+2H+=Cu+Cu2++H2O)。
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色变化
方案2:取该红色试样溶于足量的稀硫酸中,观察是否有残渣
方案3:称得干燥坩埚的质量为a g ,取红色试样置于坩埚中称得总质量为b g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称量。如此反复多次直到质量不变,称得最后质量为c g。分析数据,作出合理判断。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其工作原理;如果你认为该方案不合理,请简述原因。
。
(2)方案3中,如果a、b、c的关系符合c= 可确认红色粉末是Cu2O。
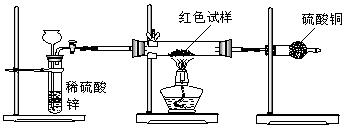 Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
Ⅲ.研究性学习小组乙,设计了新的探究方案,装置如图所示。
(3)简述新探究方案中,气体发生装置的气密性如何检验(操作、现象、结论):
。
(4)你认为依据新方案测定上述红色试样成分必须获得下列哪些物理量:(选填序号) 。
①通入氢气体积;②反应前,红色试样+硬质试管的总质量;③完全反应后红色固体+硬质试管的总质量;④实验前,干燥管(含药品)的质量;⑤硬质试管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管(含药品)的质量
(5)有人提出,在氢气发生器与硬质试管之间应加一个干燥装置,你认为 (选填“需要”或“不
需要”),简述理由 。
四、(本题包括2小题,共20分)
19.(10分)元素周期律是20世纪科学技术发展的重要理论依据之一。已知A、B、C、D、E五种元素都
是元素周期表中前20号元素。A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、
C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水。E元素原子序数均大于A、B、C、D
元素,且不与A、B、C、D元素位于同主族。
|
|
|
|
| …… |
| A |
|
|
| B |
| C | D |
|
|
根据以上信息,回答下列问题:
(1)上述五种元素中第一电离能最小的是 ,电负性最大的是 。(填相关元素的元素
符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 。
 (3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示,
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心。该化合物的电子式为 。
20.(10分)虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试
一直未获成功。直到1986年,化学家Karl Christe首次用化学方法制得了F2。他提出的三步反应如下(反
应①、②里氟元素化合价不变):
①KMnO4+KF+H2O2+HF→K2MnF6+ +H2O
②SbCl5+HF→SbF5+
③2K2MnF6+4SbF5= 4KSbF6+2MnF3+F2↑
请根据以上反应回答问题:
(1)反应①中空格上应填物质的化学式为 ;为什么填这一物质,试用氧化还原反应理论解释:
;并配平反应① 。
(2)完成反应②: 。
(3)反应③中的氧化剂为 ;被氧化的元素为 。
五、(本题包括2小题,共20分)
21.(10分)1919年,Langmuir提出,电子数相同、原子数相同的分子,互称为等电子体。以后又发展成
具有相同价电子(最外层电子)数和相同原子数的分子和离子也称等电子体。已知X是短周期元素组成的一
种新型无机非金属材料,它与碳化硅(SiC)结构相似,物理性质相近,符合“等电子体原理”。X有如下转
化关系(图中部分反应条件及部分生产物中的水已略去):其中,C是一种能使湿润的红色石蕊试纸变蓝的
无色气体,D为白色胶状沉淀,E溶液的焰色反应呈黄色,G是空气的主要成分之一。
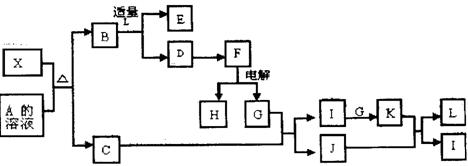 |
试回答下列问题:
(1)X属于 晶体(填“分子”、“原子”或“离子”);
(2)若仅根据“等电子体原理”,猜想X物质的化学式可能是 ;
(3)分子C的空间构型为 ;
(4)①写出X与A溶液反应的离子方程式: ;
②写出C与G反应的化学方程式: 。
 22.中国的二氧化硫排放量居世界第一。因此国家环保总
22.中国的二氧化硫排放量居世界第一。因此国家环保总
局“2006年环境监测公报”指出,减少SO2的排放和生活
废水的处理是我国“十一五”期间环境保护的主要任务。
请回答下列问题:
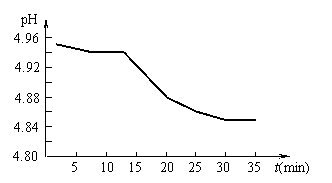
Ⅰ.SO2的排放是造成酸雨的主要因素之一。某地区酸雨
的pH随时间的变化如右图所示。请用化学方程式表示该
变化的原因 。
Ⅱ.(1)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,工业上采用了新型氨法烟气脱硫技术采用氨吸收烟气中SO2,该技术的优点是 。
(2)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个反应的化学方程式:
; 。
(3)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+![]() Sx 、CO+
Sx 、CO+![]() Sx=COS、
Sx=COS、
2COS+SO2=2CO2+![]() Sx 。其中COS分子的空间构型为 。
Sx 。其中COS分子的空间构型为 。
六、(本题包括1小题,共12分)
23. 已知金属M是用途广泛的常见金属,且常将铝粉与M等金属氧化物的混合物称为“铝热剂”,因其在在一定条件下经引发反应放出大量的热,因此这类反应称为“铝热反应”。例如:
2Al+M2O3![]() Al2O3+2M
Al2O3+2M
“铝热反应”在金属冶炼等生产实践中应用广泛。
I.(1)若M是第四周期元素,且基态原子中未成对电子数与其所在周期数相同,请写出M的核外电子排布式 。试用原子结构理论解释M2+离子具有较强还原性(M2+→M3+)的原因:
。
(2)经查阅《化学手册》知,Al、Al2O3、M、M2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | M | M2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
因此某同学推测,铝热反应所得到的熔融物可能是M和少量铝的合金。理由是: 。
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关
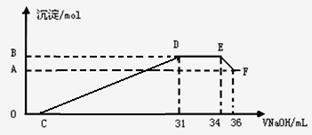 系如图所示。试回答下列问题:
系如图所示。试回答下列问题:
(3)图中OC段没有沉淀生成,此阶段发生反应
的离子方程式为 。
(4)在DE段,沉淀的物质的量没有变化,则此阶
段发生反应的离子方程式为 ;
(5)B与A的差值为 mol。
(6)B点对应的沉淀的物质的量为 mol,C点对应的氢氧化钠溶液的体积为 mL