08届高三化学第一学期联考后综合训练(16)
1、下列化学用语表示错误的是
A.次氯酸电子式 ![]() B.羟基电子式
B.羟基电子式![]()
C.镁离子结构示意图![]() D.氨分子结构
D.氨分子结构![]()
2、某碱式盐的化学式为Mg(1+x)(CO3)x(OH)2取1.55 g该固体恰好与10 mL 4mol·L-1硝酸完全反应,所得溶液仅为Mg(NO3)2溶液,则x值为
A.1
B.2
C.3
D.5
3、金属铁可分别与卤素单质化合成卤化铁,当把一定量的铁粉与碘粉混合一起研磨,生成一种Fe3I8的化合物,根据元素化合物知识,试推断在此产物中的铁元素化合价是
A 、+2
B、+3
C、+2、+3都有 D、无法判断
4、有人认为NO2可以称为混合酸酐。下列化学方程式所代表的反应中你认为能正确描述NO2是混合酸酐的化学方程式是
①2NO2+2NaOH==NaNO3+NaNO2+H2O
②2NO2+H2O==HNO2+HNO3 3HNO2==HNO3+2NO↑+H2O
③NO2+NO+2NaOH==2NaNO2+H2O
A.①②③
B.②③
C.①③
D.①②
5、有关下列三个化学反应的叙述,正确的是
①2H2S+SO2=3S+2H2O ②S+2H2SO4(浓)=3SO2↑+2H2O
③3S+6KOH=2K2S+K2SO3+3H2O
A.反应①说明SO2能与酸反应,具有碱性氧化物的性质
B.反应②改用稀H2SO4,则能放出H2
C.反应②和③说明S具有两性元素的性质 D.反应③说明S既有氧化性又有还原性
 6、NO2、NH3、O2组成的混合气体,一定条件下完全反应生成N2和H2O,则原混合气体中NO2、NH3、O2的体积比可能是(不考虑二氧化氮与四氧化二氮的转化)
6、NO2、NH3、O2组成的混合气体,一定条件下完全反应生成N2和H2O,则原混合气体中NO2、NH3、O2的体积比可能是(不考虑二氧化氮与四氧化二氮的转化)
A、2∶4∶1 B、2∶1∶2 C、1∶2∶1 D、1∶4∶3
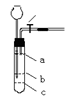
7、若要将下面装置改成可随时控制反应和停止的气体发生装置,则需在试管
里增设一带小孔隔板,你认为隔板应装在
A a处
B b处 C c处 D 任意处
8、某固定容积的密闭容器中,存在下列化学平衡. aA(g)![]() bB(g)+cC(g),
bB(g)+cC(g),
在温度不变的条件下,向容器中再充入一定量的A物质,重新达到平衡时,判
断在下列情况下有关物质量的变化趋势 (在下列空白中填写“增大”“减小”或“不变”)
(1)当a=b+c时,B的物质的量分数(2)当a>b+c时,A的物质的量分数
(3)当a<b+c时,A的转化率
A(1)减小(2)不变(3)减小 B(1)不变 (2)减小 (3)增大
C ⑴ 不变 ⑵减小 ⑶减小 D(1)减小(2)不变 (3减小)
9、(10分)(1)第二周期非金属元素的氢化物分子中去掉一个氢原子,将剩余的基团相互连接(相同或不同的基团均可以)能形成一系列新的物质。例如,二个相同的-CH3连接成CH3-CH3,相个相同的-OH连接成H2O2。将二个相同的___________连接成分子A,已知1摩尔A能与2摩尔HCl发生中和反应生成正盐,则A分子式是______________,A与过量盐酸形成盐的水溶液呈_________(酸、碱、中)性。在氧化还原反应中与H2O2相似,既可以作氧化剂,又可作还原剂。试从化合价态分析产生这种情况的原因是
___________ _____________。
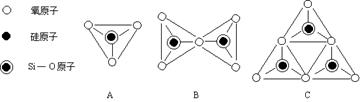
⑵原硅酸根离子SiO44- 中的Si 原子被4个O 原子所包围,可以用图A来表示其空间构型。你认为SiO44-的空间构型为 。图B 表示 (写化学式)的空间构型,图C表示 (写化学式)的空间构型。
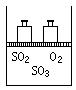 10、I(6分)如图,将4molSO2和2 mol O2混合置于体积可变的等压密闭容器中,
10、I(6分)如图,将4molSO2和2 mol O2混合置于体积可变的等压密闭容器中,
在一定温度下发生如下反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0。该反应达
2SO3(g);ΔH<0。该反应达
到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
(1)在该平衡状态时n(SO3)=______________________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各
气体的体积分数与上述平衡状态相同,x的取值为____________________________;
(3)若反应开始时的V(逆)>V(正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。
则起始时n(SO3)的取值范围是________________________________。
II(7分)在一定温度下,有1mol N2气体和3mol H2气体发生下列反应:
N2(g)+3H2(g) ![]() 2NH3(g);ΔH<0
2NH3(g);ΔH<0
(1)若在相同温度下,分别在1L定压密闭容器中和1L定容容器中反应(密闭):
哪个容器中的反应先达到平衡? 答: 哪个容器中的N2的转化率高? 答:
(2)若在上述定压密闭容器中,反应已达到平衡时,再加入0.5mol氩气,则N2的转化率会起
什么变化?正反应速度与原平衡相比,有无变化,简答理由。
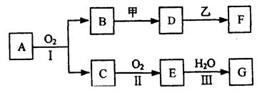
11、 (10分) 物质的转化关系如下图所示(有的
反应可能在水溶液中进行)。其中A为化合
物,甲可由两种单质直接化合得到,乙为金
属单质,G为酸,乙在G的浓溶液中发生钝
化。
(1)若A为黄色固体,C能使品红试液褪色,D的
水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成。则
①工业上反应I在
中进行,反应Ⅲ在
(均填设备名称)中进行。
②由两种单质直接化合得到甲的反应条件是
或
。
③反应I的化学方程式是
。
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它
们接近,有大量白烟生成。则①D的溶液与乙反应的离子方程式是
。
②若1.7gA与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式
综合训练(16)参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| C | C | A | D | D | A | B | C |
9.(10分)(1)-NH2 N2H4、 酸 -2价N化合价既可升高,又可降低
⑵ 空间正四面体 (1分) 、Si2O76-
(2 分)、Si3O96-
(2 分)
10.I(1)3.6 mol
(2)≥0 (说明:答“任意值”可得分) (3)3.6 mol< n (SO3)≤4mol
II(1)定压容器、定压容器(2)N2的转化率以及正反应速度都降低。理由是:由于反应容器保持定压,所以当加入氩气后,反应容器的容积会增大,使得反应容器中的各物质的浓度降低,所以正反应速度降低(逆反应速度也降低),从反应物及产物的系数可以看出,反应物的系数比产物的系数大,所以,容器容积增大对正反应速度降低的效果更为明显,故平衡向逆反应方向移动,使N2的转化率降低
11.(1)①沸腾炉 吸收塔 ②点燃,光照 ③4FeS2+11O2 ![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)① ![]() ②2Al+2OH-+2H2O=2AlO2-+3H2↑
②2Al+2OH-+2H2O=2AlO2-+3H2↑
③4NH3(g)+5O2(g)=4NO(g)+6H2O(g);ΔH=-906.8kJ/mol