08届高三化学第一学期联考后综合训练(3)
1.下列实验操作会导致实验结果偏低的是( )
①配制100g10%的CuSO4溶液,称取10gCuSO4 晶体溶于90g水中
②测定CuSO4晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的H2SO4溶液,定容时俯视容量瓶的刻度线
④中和滴定时,用含KOH的NaOH 配制成的标准溶液滴定未知浓度的HCl
A.只有② B.只有① C.②③④ D.①③④
2.阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是( )
A.常温常压下,18.0g重水(D2O)所含的电子数约为10×6.02×1023
B.标准状况下,aL甲烷与乙烷混合气体中的分子数为 (a/22.4)×6.02×1023
C.标准状况下,22.4L甲苯所含的分子数约为6.02×1023
D.室温下,42.0g乙烯与丙烯的混合气体中含有的碳原子数约为3×6.02×1023
3.有一种生产碘的工作方法是用亚硫酸氢钠还原碘酸盐( IO3-)。每还原出1molI2 分子,理论上需要用去亚硫酸氢纳( ) A.5mol B.2mol C.2.5mol D.1mol
4.下列物质间反应的离子方程式正确的是( )
A.Fe3O4 溶于氢碘酸中: Fe3O4 +8H++2I-== 3Fe2+ + I2 +4H2O
B.次氯酸钙溶液中通入过量二氧化碳:Ca2+ + 2ClO- +H2O+CO2 == CaCO3↓+ 2HClO
C.Cl2 与FeBr2 按 1:2物质的量的比在溶液中反应:2Cl2 +2Fe2+ +2Br-== 4Cl-+2Fe3+ +Br2
D.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2 +4H+ == Fe3+ + 4H2O
5.气体X可能含有NH3、Cl2、HBr、CO2中的一种或几种。已知X通入AgNO3溶液中时产生淡黄色沉淀,该沉淀不溶于稀硝酸,若将X通入澄清石灰水中,不见沉淀生成,有关气体X的成分说法正确的是( )
A.可能含有Cl2 B.一定含有CO2 C.一定含HBr D.一定不含有NH3、CO2
6.硫氰化学式为(SCN)2,结构式为N![]() C—S—S—C
C—S—S—C![]() N,其分子及阴离子 (SCN-)的性质都与卤素相似。下列关于硫氰的叙述不正确的是(
)
N,其分子及阴离子 (SCN-)的性质都与卤素相似。下列关于硫氰的叙述不正确的是(
)
A.与水反应可生成两种酸 B.与氢氧化钾溶液反应产物之一为KSCN
C.NaSCN与AgSCN受热发生分解 D.HSCN浓溶液与MnO2共热可生成(SCN)2
7.将16.8gNaHCO3与一定量的Na2O2固体混合,在加热的条件下使其反应,经测定没有Na2O2剩余,则最后所得固体的物质的量为( )
A.0.1mol—0.2mol之间 B.0.1mol—0.4mol之间 C.0.2mol—0.4mol之间 D.大于0.4mol
8.取相同体积的KI、Na2S、FeBr2溶液,分别通入适量Cl2,当反应恰好完成时,3种溶液消耗Cl2的体积相同(同温同压下),则KI、Na2S、FeBr2溶液的物质的量浓度之比为( )
A.1:1:2 B.1:2:3 C.6:3:2 D.2:1:2
9.在密闭容器中充入CO2 、CO、CH4的混合气体共m g,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体的质量增重m g,则CO2与CH4的体积比为( )
A.3:1 B.2:1 C.1:1 D.缺少条件,无法求算
10.(12分)(1)配平下列离子方程式:Ix- + Cl2 + H2O —→Cl- + IO3- + __________
在反应中,若消耗Ix- 与 Cl2 物质的量之比为1:8,则 x =__________。
(2)向MnSO4和硫酸的混合溶液中加入K2S2O8(过二硫酸钾),溶液会发生如下反应:
Mn2+ +S2O82-+H2O —→MnO4- +SO42-+H+ 若反应中有0.1mol还原剂参加反应,则消耗氧化剂物质的量为______mol。
(3)若该反应所用的硫酸锰改为氯化锰,当它与过量的过二硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有____________
![]()
|
![]()
|
|
![]()
![]()
![]()
![]() (2)B加热产生D的化学方程式为:______
加稀H2SO4
(2)B加热产生D的化学方程式为:______
加稀H2SO4
![]()
|
(3)A、B加热后,若只得到一种固体化合物,则A与B的物质的量之比的最大值为____
(填数字)
12.(10分)图中A、B是常见的化学实验装置,请回答下列问题:
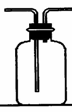
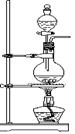
A(制气装置) B(洗气装置)
(1)利用A装置,当不加热时,可制取的一种气态单质是_____________;当加热时,可制取的一种气态化合物是________________________。
(2)化学实验室用A装置加热制取氯气,化学方程式为:________________________。
(3)为得到纯净、干燥的氯气,可让A中出来的气体在进入收集装置前依次通过分别装有_________和____________的两个洗气瓶B。
(4)实验室制取Cl2和CO2都可用瓶口向上排空气集气法收集,具体操作有何不同?为什么?
___________________________________ _______________________________________
13.(8分)白色粉末A是NaHCO3与KHCO3的混合物,取甲、乙、丙三份质量不同的样品分别与50.0mL相同浓度的盐酸充分反应,得到气体的体积(标准状况下)与A的质量关系如下表:
| 实验组别 | 甲 | 乙 | 丙 |
| 稀盐酸体积/mL | 50.0 | 50.0 | 50.0 |
| A样品的质量/g | 2.84 | 5.25 | 7.00 |
| 气体体积/L | 0.672 | 0.896 | 0.896 |
求:(1)该盐酸的物质的量浓度。 (2)混合物中NaHCO3的质量分数。
综合训练(3)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | B | D | A | A | C | C | B | C | C |
10、(12分)⑴2 5X+1 6X 10X+2 2X 12XH+ 3 ⑵0.25 ⑶Cl2
11、(10分)⑴Na2O2 O2
⑵ 2NaHCO3== Na2CO3+CO2+H2O HCO3- +H+ == CO2+H2O ⑶ 1/2
12、(10分)⑴H2(O2 、 Cl2 ) HCl ⑵MnO2+4HCl(浓)==MnCl2+ Cl2+2H2O
⑶饱和食盐水、浓H2SO4
⑷ Cl2必须隔绝大气收集,且尾气要用NaOH溶液吸收后再排放;因为Cl2有毒会污染空气,而CO2不会污染空气。
13、(8分)⑴0.8mol/l ⑵29.6%