08届高三化学第一学期联考后综合训练(4)
1.贮存液氯的钢筒,为了防止被腐蚀,装氯之前必须进行的操作是
A.用蒸馏水洗净 B.用盐酸清洗 C.钢筒内充入惰性气体 D.使钢筒充分干燥
2.通过分析周期表结构和各元素性质的变化趋势,判断砹(原子序数为85)及其化合物的叙述正确的是
A. 由KAt的水溶液制备At的化学方程式为2KAt + Cl2 == 2KCl + At2
B.相同条件下,AgAt比AgI难分解
C.AgAt是一种易溶于水的固体 D.At在第五周期VIIA族
3.下列实验操作错误的是
A.蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口
B.分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
C.配制浓硫酸与浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,并及时搅拌和冷却
D.欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
4.向等物质的量浓度的两种一元弱酸盐溶液中分别通入适量的CO2,发生如下反应:
NaR + CO2 + H2O →HR + NaHCO3 2NaR + CO2 + H2O→2HR+Na2CO3
则HR和HR′的酸性强弱关系为
A.HR较强 B.HR′较强 C.两者一样 D.无法比较
5.将0.3mol·L-1的KOH溶液与0.1mol·L-1的H3PO4溶液等体积混合,溶液中各离子的关系正确的是
A.C(K+)+C(H+)= C(OH-)+ C(H2PO4-)+C(PO43-)
B.C(K+)+C(OH-)= C(H+)+3C(PO43-)+4C(HPO42-)+ 5 C(H2PO4-)+6 C(H3PO4)
C.C(K+)> C(PO43-)> C(HPO42-)> C(H2PO4-)> C(H3PO4)
D.C(PO43-)+ C(HPO42-)+ C(H2PO4-)+ C(H3PO4)=0.1mol·L-1
6.CuI是一种不溶于水的白色固体。它可由反应:2 Cu2+ + 4I- == 2CuI + I2而得到,现以石墨为阴极,以铜为阳极电解KI溶液,通电前向电解质溶液中加入少量酚酞和淀粉溶液。电解开始不久阴极区溶液呈红色,而阳极区呈蓝色,对这个现象的正确解释是
A. 阴极电极反应 2H+ +2e -== H2↑,使C(OH-)> C(H+)
B.阳极:2Cu + 4I- – 4e- == 2CuI↓+ I2, I2使淀粉变蓝
C.阳极:Cu-2e- == Cu2+, Cu2+显蓝色 D.阳极:2I- –2e- == I2,碘遇淀粉变蓝
7.在一个密闭容器中,加mmolA、nmolB,发生下列反应:mA(g)+nB(g) ![]() pC(g),平衡时C的浓度为Wmol·L-1。若保持压强和温度不变,起始时放入amolA,bmolB,cmolC,使平衡后C的浓度仍为Wmol·L-1。则a、b、c的关系不可能的是
pC(g),平衡时C的浓度为Wmol·L-1。若保持压强和温度不变,起始时放入amolA,bmolB,cmolC,使平衡后C的浓度仍为Wmol·L-1。则a、b、c的关系不可能的是
A.a∶b∶c =m∶n∶p B.a∶b =m∶n , ![]() +c=p
+c=p
C. ![]() +a = m,
+a = m, ![]() +b =n
D.a=
+b =n
D.a=![]() ,b=
,b=![]() ,c=
,c=![]()
8.(8分)亚硝酸钠NaNO2可用做水泥施工的抗冻剂。它易溶于水,有咸味,既人氧化性,也有还原性。在酸性溶液中它能氧化碘离子、亚铁离子。它能将人体内血红蛋白里的亚铁离子氧化为三价铁离子而使人中毒,在建筑工地上多次发生把亚硝酸钠作食盐食用,导致民工中毒的事件。亚硝酸钠和酸反应生成亚硝酸,亚硝酸是不稳定的的弱,它只存在于冷的稀溶液中,易发生如下反应:3HNO2 = 2NO↑+ HNO3 + H2O
从浓醋酸、氨水、纯碱、稀盐酸、碘化钾淀粉溶液中选择适当的物质作试剂,用两种简单的化学实验鉴别亚硝酸钠和氯化钠。试写出两种实验方法使用的试剂和据此鉴别它们的现象。
(1) 方法一(只用一种试剂),试剂:___________________,现象:__________________
____________________________________________。
(2) 方法二,试剂:_______________________,现象: ________________________
___________________________ 。
9.(7分)已知A、B、C、D均为短周期元素,它们的原子序数依次递增。A是最外层为一个电子的非金属,C原子的最外层电子数是次外层的3倍;C和D可形成两种固体化合物,其中一种为淡黄色固体;B和C可形成多种气态化合物。由A、B、C三种元素可形成离子晶体,该晶体中各元素原子的物质的量之比为A∶B∶C = 4∶2∶3。请回答下列问题:
⑴写出C和D形成的淡黄色固体化合物的电子式______________。
⑵元素原子的物质的量之比为A∶B∶C = 4∶2∶3的晶体名称为_____________________,其水溶液显_________________性,其反应的离子方程式为__________________________。
⑶请写出与A2C和BA3分子中电子数相同,且仍由A、B、C元素中任意两种元素组成的粒子的符号(举两例)___________、___________。
⑷写出由B、C元素组成元素原子质量比为B∶C = 7∶12的化合物的化学式_____________。
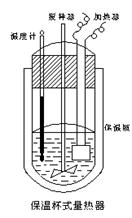 10.(10分)在量热计(下图)中将100cm3、0.500mol·L-1CH3COOH溶液与100cm3、0.500mol·L-1NaOH 溶液混合,温度从298.16K升高到300.71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150.5J·K-1,0.250 mol·L-1CH3COONa溶液比热容为4.03J·g-1·K-1,
10.(10分)在量热计(下图)中将100cm3、0.500mol·L-1CH3COOH溶液与100cm3、0.500mol·L-1NaOH 溶液混合,温度从298.16K升高到300.71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150.5J·K-1,0.250 mol·L-1CH3COONa溶液比热容为4.03J·g-1·K-1,
溶液的密度为0.963g·cm-1。
⑴试求CH3COOH的中和热。
⑵CH3COOH的中和热的文献值为56.1KJ· mol-1,请你分析⑴中测得的实验值偏差可能是什么原因造成的? 。
⑶已知HCl(aq) +NaOH(aq) = NaCl(aq) +H2O(l) △H =-57.3KJ· mol-1;现有①CH3COOH ② 浓H2SO4③ HNO3与NaOH溶液反应的反应热分别为△H1、△H2、△H3,则△H1、△H2、△H3三者的大小关系为:___________________________。
综合训练(4)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | D | A | D | A | BC | AB | D |
8.(1)浓醋酸 容器口有红棕色气体出现的原物质为NaNO2
(2)稀盐酸.碘化钾淀粉溶液 反应后溶液呈蓝色的物质为NaNO2
![]() 9. Na+[
9. Na+[![]() ]2-Na+ (2)硝酸铵 酸 NH4++OH- NH3 •H2O NH4+ 、H3O+
(4)N2O3
]2-Na+ (2)硝酸铵 酸 NH4++OH- NH3 •H2O NH4+ 、H3O+
(4)N2O3
10. (1)47.3 (2)原因是CH3COOH的电离为吸热反应,且反应后生成的CH3COONa水解也要吸收热量 (3) △H1>△H3>△H2