08届高三化学第一学期联考后综合训练(7)
1.下列说法不正确的是 ( )
A.0.2mol/L的NaHCO3溶液中:[Na+]>[HCO3-]>[OH-]>[H+]
B.叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为:
c(Na+)>c(N3—)>c(OH—)>c(H+)
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:[NH4+] = [Cl-]
D.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
2.某溶液中大量存在的五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO3-):n(SO42—):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为 ( )
A.Fe2+ B.Mg2+ C.CO32— D.Ba2+
3.在粗碘中含有IBr和ICl,受热时,I2、ICl、IBr均可升华。在粗碘中加入一种物质后,再进行升华,可制得精碘,应加入的物质是 ( )
A.KI B.Zn C.KCl D.H2O
4.对于①a g Na2CO3 ②a g Na2CO3和NaHCO3的混合物,下列描述正确的是 ( )
A.分别配成等体积的溶液,②的pH大 B.分别与盐酸反应时,②耗酸量大
C.分别与足量盐酸反应,②放出CO2多 D.分别配成等体积的溶液,②中Na+浓度大
5.对锂的结构和性质的判断,错误的是 ( )
①与水反应比钠剧烈 ②它的原子半径比钠小 ③它的氧化物暴露于空气中易吸收水分
④它的单质可做还原剂 ⑤它的阳离子的最外层电子数与钠离子的最外层电子数相同
A.只有① B.③和④ C.②和③ D.①和⑤
|
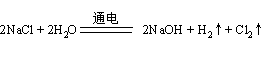
A.用Pt电极电解MgCl2溶液 2Cl-+2H2O 2OH-+H2↑+Cl2↑
B.碳酸氢钙溶液中加入足量氢氧化钠溶液:Ca2++HCO3—+OH— = CaCO3↓+H2O
C.FeCl3溶液中通入H2S气体 Fe3++H2S=Fe2++S↓+2H+
D.向烧碱溶液中滴加少量氯化铝溶液 Al3++4OH-=[Al(OH)4]-
7.下列各组溶液,不用其他试剂就不能鉴别的是 ( )
A.FeCl3、NaNO3、Na2CO3、NaCl B.NaOH、MgSO4、Na2CO3、NaHSO4
C.AgNO3、KNO3、KCl、NaBr D.HCl、BaCl2、NaOH、CuSO4
8.X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含该三种元素的化学式:①X2Y2Z2 ②X2YZ3 ③X2YZ2 ④X2Y2Z4 ⑤X3YZ4 ⑥XYZ3,其中可能存在对应分子的是( ) ( ) A.② B.②④ C.②⑤⑥ D.①②③④
9.用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( )
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 | Ca(OH)2溶液 |
10.(5分)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):___________ ___。 ②容量瓶:_______________________。
③滴定管:__________________________ ______________________________。
④集气瓶(收集氯化氢):___________ ___。 ⑤托盘天平__________________________。
11.(13分)图2是一个制取氯气并以氯气为原料进行特定反应的装置。
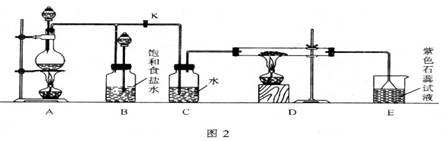
(1)A是氯气发生装置,其中发生反应的化学方程式为__________________________。
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让![]() 充满整个装置,再点燃D处酒精灯,连接上E装置。
充满整个装置,再点燃D处酒精灯,连接上E装置。![]() 通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为
通过C瓶后再进入D。D装置的硬质玻管内盛有炭粉,发生氧化还原反应,其产物为![]() 和HCl。试写出D中反应的化学方程式:______________________,装置C 的作用是__________________________。
和HCl。试写出D中反应的化学方程式:______________________,装置C 的作用是__________________________。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色。其原因是
__________________________。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为_____________ (选填序号)。
A.有白色沉淀生成 B.无明显的现象 C.先生成白色沉淀,而后白色沉淀消失。
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用。A处仍有![]() 产生,此时B中的现象是_____________,B的作用是_____________。
产生,此时B中的现象是_____________,B的作用是_____________。
(6)若实验中使![]() 浓盐酸10mL与足量的
浓盐酸10mL与足量的![]() 反应。则生成的
反应。则生成的![]() 的物质的量总是小于0.03mol,试分析可能存在的原因是①_____________,②_____________。欲使反应生成的
的物质的量总是小于0.03mol,试分析可能存在的原因是①_____________,②_____________。欲使反应生成的![]() 的物质的量最大程度的接近0.03mol。则实验中应采取的措措施是____________。
的物质的量最大程度的接近0.03mol。则实验中应采取的措措施是____________。
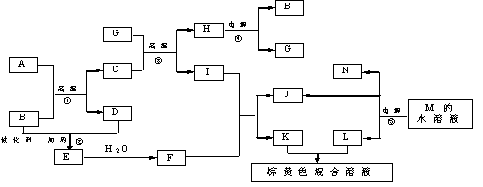
12.(12分)根据反应框图填空,已知反应①~⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、J、L为气体。A是工业生产中重要的矿石原料的主要成份,其相对分子质量为120。 (1)写出A、B的化学式A_____________ B________________
(2)写出下列化学反应方程式:反应②的化学方程式______________________________
反应③的化学方程式____________________反应⑤的离子方程式______________
(3)写出下列反应在工业生产所使用设备的名称
反应①所使用设备的名称_________________________________
综合训练(7)参考答案
1 D 2B 3 A 4 C 5 D 6 D 7 A 8 D 9 B
10.(5分)(1)把试纸用蒸馏水湿润 (2)检查容量瓶是否漏水
(3)用待装液润洗滴定管2~3次(也可以写:检查滴定管是否漏水)
(4)干燥集气瓶 (5)调节零点
11.(13分)(1)MnO2+4HCl(浓)===MnCl2+Cl2+2H2O(2分)
(2)C+2Cl2+2H2O===CO2+4HCl(2分),提供水蒸气。(1分)
(3)生成 HCl气体溶于水使石蕊变红,多余的氯气溶于水生成HClO使石蕊褪色。(2分)
(4)B(1分) (5)溶液进入漏斗中。贮存氯气。(2分)
(6)①HCl挥发②盐酸变稀,与二氧化锰不反应。加热不宜过猛。(3分)
12.(12分)(1)FeS2 O2 (每空2分)
(2)

 (每空2分) (3)沸腾炉 (2分)
(每空2分) (3)沸腾炉 (2分)