08届高三化学第一学期联考后综合训练(8)
1.下列说法一定正确的是
A.PH=2盐酸和醋酸溶液各10ml,分别加水稀释到 1L,所得溶液的PH较小的是醋酸
B.短周期元素χ的阳离子与短周期元素Y的阴离子具有相同的电子层结构,则两元素的最高化合价χ>Y
C.二氧化硅晶体中,每个硅原子与2个氧原子形成共价键
D.在晶体中只要有阳离子就一定有阴离子
2.短周期元素A、B、C的原子序数依次递增,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是
A.原子半径:A<B<C B.高温下,A单质能置换出C单质
C.三种元素的最高价氧化物对应水化物均可由化合反应得到
D.A的氢化物稳定性小于C的氢化物稳定性
3.A、B、C为第二或第三周期的元素,A、B同周期,A、C的阴离子分别为A2-和C-,B2+和C-具有相同的电子层结构,下列说法正确的是
A.原子最外层电子数: A> C >B B.离子半径:C->A2->B2+
C.沸点: HC>H2A
D.B和C形成的化合物的电子式
![]()
4.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为: ⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+
S+2H2O。 ⑵ 除去反应混合物中的不溶物
![]() ⑶ 电解混合液MnSO4+ZnSO4+2H2O M MnO2+Zn+2H2SO4 下列说法不正确的是
⑶ 电解混合液MnSO4+ZnSO4+2H2O M MnO2+Zn+2H2SO4 下列说法不正确的是
A.硫酸在生产中可循环使用 B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生 D.步骤⑴中MnO2和H2SO4都是氧化剂
5.下列说法正确的是
A、离子半径:Ca2+<S2-,原子半径:Na>Cl
B、从上到下,卤素的非金属性逐渐减弱,故氢卤酸的酸性依次减弱
C、因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
D、钠在反应中失去的电子比铝少,故钠的金属性小于铝的金属性
6.RO3- 酸根所含电子数比硝酸根离子NO3- 的电子数多10,下列关于R和N的说法正确的是 A.R和N元素的最高正化合价相同 B.R在周期表的周期序数和族序数分别比N多1 和2
C.RO3-和NO3-都只能被还原,不能被氧化 D.R和N两种元素的单质都是空气的主要成分
7.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A、L、M的单质与稀盐酸反应速率L>M B、Q、T两元素的氢化物分子间存在氢键
C、M与T形成的化合物有两性 D、L、Q形成的简单离子核外电子数相等
8。有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是
A.若Y的最高正价为+m,则X的最高正价一定为+m
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若X(OH)n为强碱,则Y(OH)n也一定为强碱
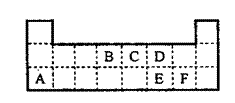 9.下表是元素周期表的一部分。表中所列的字母分别代表某一元素。(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为
。
9.下表是元素周期表的一部分。表中所列的字母分别代表某一元素。(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为
。
(2)写出B的最高价氧化物的电子式 。
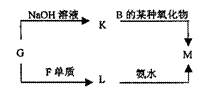 (3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化
(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化
其中化合物M是一种白色胶状沉淀,则M的化学式为 ;
K的溶液与B的某种氧化物反应的化学方程式为 ;L与氨水反应的离子方程式为 ; 一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
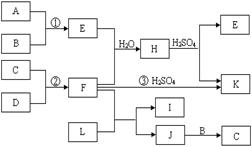 10.下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
10.下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥。(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得。(e)化合物J由两种元素组成,其相对分子质量为32。
请按要求填空:
⑴反应③的化学方程式______ ________。
⑵C的电子式______________;H的化学式______________。
⑶L的溶液与化合物E反应的离子方程式
__________ ____。
⑷化合物J的化学式_____ _________。
11.U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_______________;XW的电子式为____________;
Z元素在周期表中的位置是_____________。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____________;V、W的氢化物分子结合H+能力较强的是(写化学式)______________,用一个离子方程式加以证明_________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为______,由此可知VW和YW2还原性较强的是(写化学式)______。
综合训练(8)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | B | C | D | A | B | C | D |
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() 9.(12分 每空2分)(1)11.2L(2) O C O (3)Al(OH)3
9.(12分 每空2分)(1)11.2L(2) O C O (3)Al(OH)3
NaAlO2 +CO2+2H2O
|
10.(12分) (1) 2NH3 + H2SO4
![]() (NH4)2SO4 (3分)
(NH4)2SO4 (3分)
![]()
![]()
![]()
![]() (2) N N (NH4)2SO3
或NH4HSO3 (各2分,共4分)
(2) N N (NH4)2SO3
或NH4HSO3 (各2分,共4分)
(3) ClO– + SO2 + H2O![]() Cl– + SO42– + 2H+(3分) (4) N2H4 (2分)
Cl– + SO42– + 2H+(3分) (4) N2H4 (2分)
11.(16分)⑴. N≡N(2 分)
![]() ( 2分) 第4周期,第VIII族 (2分)
( 2分) 第4周期,第VIII族 (2分)
⑵.① ③ (2分) ⑶.CH4 NH3(各1分,共2分) NH3 + H3O+=== NH4+ + H2O(2分)
⑷.3SO2 + 2NO3- + 3Ba2+ + 2H2O ==== 3BaSO4 ↓ + 2NO ↑+ 4H+(2分) SO2(2分)