08届高三化学第一学期联考后综合训练(9)
1. 一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI。它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn==ZnI2+ZnAt2 AtI+2NH3(1)==NH4I+NH2At 。则下列叙述正确的是( )
A.ZnI2既是氧化产物,又是还原产物 B.ZnAt2既是氧化产物,又是还原产物
C.AtI与液氨反应,AtI既是氧化剂又是还原剂 D.AtI与液氨反应,是自身氧化还原反应
2.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.常温常压下,22g氧气和26g臭氧混合气体所含氧原子总数为3×6.02×1023
B.1L0.5mol/L的CH3COONa溶液中含有的CH3COO-数为0.5×6.02×1023
C.常温常压下,16g 14CH4所含中子数为8×6.02×1023
D.1 mol Cl2发生反应时,转移的电子数一定是2 NA
3. 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程为:用NaOH调NiCl2溶液pH至7.5,加适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是( )
A、可用铁作阳极材料 B、电解过程中阳极附近溶液的pH升高
C、阳极反应方程式为:2Cl--2e-=Cl2
D、1mol二价镍全部转化为三价镍时,外电路中通过了2mol电子。
4.下列说法正确的是( )
A、原子晶体中只存在非极性共价键 B、稀有气体形成的晶体属于分子晶体
C、干冰升华时,分子内共价键会发生断裂
D、金属元素和非金属元素形成的化合物一定是离子化合物
5.常温下,下列溶液中一定能大量共存的离子组是( )
A.含有大量S2-的溶液:ClO-、Na+、Cl-、CO32-
B.无色澄清溶液:MnO4-、SO42-、K+、Fe3+
C.能使pH试纸变红的溶液:NH4+、Na+、SO42-、Fe3+
D.水电离产生的c(H+)=1×10-12mol/L的溶液:HCO3-、NH4+、Cl-、Ca2+
|
A.电解法制铝时一般是用熔融态的氧化铝进行电解但也可用其相应的盐,如熔融态的A1C13
B.电解法生产铝时,需对铝土矿进行提纯,在提纯过程中应用了氧化铝或氢氧化铝的两性
C.在氯碱工业中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.氯碱工业和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
7.向2mL0.5mol/L的FeCl3溶液中加入3 mL5mol/L的KF溶液,发现FeCl3溶液渐渐褪至无色,再加入KI溶液和CCl4振荡后,静置,不见CCl4层有紫红色,则下列说法正确的是( )
A.Fe3+不与I-发生反应 B.Fe3+与F-结合成不与I-反应的物质
C.F-使I-的还原性减弱 D.Fe3+被F-还原为Fe2+ ,使溶液中不再存在Fe3+
![]() 8.一定温度下,在恒容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
8.一定温度下,在恒容器中发生如下反应:2A(g)+B(g) 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 ( )
A.1mol B和1mol C B.1mol A 1mol B和1mol He(不参加反应)
C.2mol C D.2mol A 3mol B和3mol C
9.(6分)Ⅰ.在某压强恒定的密闭容器中加入2mol N2和4mol H2,发生如下反应:
![]() N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol。达到平衡时,体积为反应前的三分之二。求: (1)达到平衡时,N2的转化率为
。
N2(g)+3H2(g)
2NH3(g);△H=-92.4kJ/mol。达到平衡时,体积为反应前的三分之二。求: (1)达到平衡时,N2的转化率为
。
(2)若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均为正数,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。试比较反应放出的能量:(1) (2)(填“>”、“<”或“=”)。
Ⅱ.若将2mol N2和4mol H2放入起始体积相同的恒容容器中,在与I相同的温度下达到平衡。 试比较平衡时NH3的浓度:I Ⅱ(填“>”、“<”或“=”)。
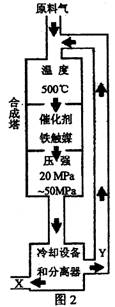
10.(11分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图
|
②图2中条件选定的主要原因是(选填字母序号) ;
A.温度、压强对化学平衡影响 B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
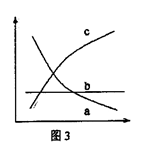
③改变反应条件,会使平衡发生移动。如图3表示随条件改变,
氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势
正确的是(选填字母序号) ,当横坐标为温度时,
变化趋势正确的是(选填字母序号) 。
 (2)常温下氨气极易溶于水,其水溶液可以导电。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的
;
②氨水中水电离出的c(OH—) 10—7mol/L(填写“>”、
“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为
|
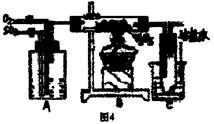
11.(13分)图4是某化学小组在实验室研究二氧化硫
催化氧化并制取三氧化硫晶体的装置。
(1)检查装置的气密性,加入药品后,进行实验。
A装置可控制SO2和O2的进气量,理论上A
中两导管(口径大小相同)冒出气泡的速率
应是 ,实验时中两导管冒出气泡
的速率大致相同,其原因是 。
A处装的药品是 。C中的实验现象是 ,从C端排出的尾气的成分是 ,为减轻实验对环境污染,请你设计尾气处装置,用简要文字说明所加试剂及操作顺序 。
(2)已知6.4克二氧化硫氧化成气态三氧化硫放出的热量为9.83kJ,该热化学方程式为
,若将2mol SO2和1 mol O2充入一密闭容器反应,SO2的转化率为9%,此时△= (上述反应的条件相同)。
(3)若将 将从500℃变为400℃时,v(正) ,(填“增大”、“不变”或“减小”,下同),c(SO3):c(SO2)的比值 ,SO2转化率 。
综合训练(9)参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | A | C | B | C | B | B | C |
9.(6分)(1)50%(2分);(2)>(2分);(3)>(2分)
10.(11分)(1)NH3(2分) ②BC(只选1个且正确给1分,错选、多选不给分)(2分)
③c (1分) a(1分)
![]()
![]() (2)①NH3+H2O NH3·H2O NH4++OH—(2分)
(2)①NH3+H2O NH3·H2O NH4++OH—(2分)
②<(1分) ③c(Cl—)>c(NH4+)>c(H+)>c(OH—)(2分)
11.(13分)(1)理论上v(O2):v(SO2)=1:2,使价价廉的O2过量,提高SO2的转化率。A处装的药品是浓硫酸(干燥水蒸汽)。C中有无色晶体生成。从C端排出的尾气有SO2、O2和SO3,将尾气依次通过浓硫酸的洗气瓶、NaOH溶液的洗气瓶(或足量碱石灰干燥管,只有NaOH溶液吸收不行,SO3溶于水要形成酸雾)
![]() (2)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol △H=-196.6kJ/mol
(2)2SO2(g)+O2(g) 2SO3(g);△H=-196.6kJ/mol △H=-196.6kJ/mol
(3)温度降低,v(正)减小,c(SO3)/c(SO2)增大。SO2的转化率增大。