08届高三化学第一学期期终测试卷
(完卷时间:120分钟 满分:150分)
(答案均填写在答题纸上)
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Ca-40 Fe-56 Cu-64
第Ⅰ卷 (共66分)
一、选择题(本题共10分)每小题2分,只有一个正确选项。
1、下列物质中不含结晶水的是 ( )
A、芒硝 B、大理石 C、明矾 D、生石膏
2.元素单质的化学性质主要决定于 ( )
A、原子核内的质子数 B、原子核内的中子数
C、原子的质量数 D、原子的核外电子数及其排布情况
3. 下列金属冶炼的反应原理,错误的是 ( )
A、MgCl2 ![]() Mg+ Cl2↑
B、2 CuO
Mg+ Cl2↑
B、2 CuO ![]() 2 Cu + O2↑
2 Cu + O2↑
C、Fe2O3 + 3 CO ![]() 2 Fe + 3 CO2 D、2
HgO
2 Fe + 3 CO2 D、2
HgO ![]() 2 Hg + O2↑
2 Hg + O2↑
4. 通过化学反应不能实现的是 ( )
A、生成一种新的离子 B、生成一种新的分子
C、生成一种新的同位素 D、生成一种新的单质
5. 下列各组物质的相互关系正确的是 ( )
A、同位素:1H+、2H-、2H2、2H、3H
B、同素异形体:C60、C70、金刚石、石墨
C、同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
D、同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯
二、选择题(本题共36分)每小题3分,只有一个正确选项。
6. 下列物质中,在空气里不易变质,且可以用无色玻璃试剂瓶存放的是 ( )
A、钠 B、苯酚 C、醋酸 D、新制氯水
7. 右图是电解CuCl2溶液的装置,其中c、d为石墨电极,已知溶液中Cl-离子向c极移动,则下列有关判断正确的是 ( )
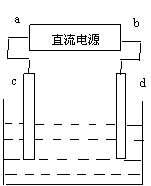 A、a为负极,b为正极
A、a为负极,b为正极
B、c为阳极,d为阴极
C、电解过程中,c极质量增加
D、电解过程中,Cl-离子浓度不变
8. 下列颜色变化与化学反应无关的是 ( )
① 碘遇淀粉显蓝色;② 苯酚晶体空气中变红色;③ 二氧化硫使品红溶液褪色;
④ 酸碱指示剂遇酸或碱变色;⑤ 活性炭使NO2气体褪色。
A、①②④ B、①②⑤ C、只有⑤ D、②④⑤
9. 下列实验事实可用来证明氨水是弱碱的是 ( )
A、氨水能跟氯化铁溶液反应生成氢氧化铁沉淀
B、铵盐受热易分解
C、0.1 mol·L-1的氨水可以使酚酞试液变红
D、常温下,0.1 mol·L-1的氯化铵溶液的pH值约为5
10. NA代表阿伏加德罗常数,下列说法正确的是 ( )
A、在同温同压下,相同体积的任何气体单质所含的原子数目相同
B、2 g氢气所含原子数目为NA
C、在常温、常压下,11.2 L氮气所含的原子数目为NA
D、17 g氨气所含的电子数目为10 NA
11. 用萃取法从碘水中分离碘,所用萃取剂应具有的性质是 ( )
① 不与碘和水发生化学反应;② 密度比水大 ;③ 密度比水小 ;④ 难溶于水 ;⑤ 易溶于水;⑥ 碘在其中的溶解度比碘在水中的溶解度大。
A、①②④⑥ B、①③⑤⑥ C、①④⑥ D、②④⑥
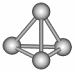
12. 最近意大利科学家获得了极具理论研究意义的N4分子。N4分子的结构如下图所示。已知断裂1 mol N-N吸收167 KJ热量,生成1 mol N≡N放出942 KJ热量。根据以上信息,判断下列说法正确的是 ( )
|
A、N4属于一种新型化合物
B、N4转化为N2的过程是一个吸热过程
C、N4与N2互为同素异形体
D、N4沸点比P4(白磷)高
![]() 13. 已知柠檬醛的结构简式为:CH3-C=CH-CH2-CH2-C=CH-CH 。
13. 已知柠檬醛的结构简式为:CH3-C=CH-CH2-CH2-C=CH-CH 。
CH3 CH3 O
下列说法不正确的是 ( )
A、它能跟银氨溶液发生银镜反应
B、它能使酸性高锰酸钾溶液和溴水褪色
C、它不能发生消去反应
D、它催化加氢的最终产物的分子式为C10H20O
14. 0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的盐酸等体积混合后,溶液中下列微粒的物质的量浓度的大小关系正确的是 ( )
A、c(CH3COO-) = c(Cl-) = c(H+) > c(CH3COOH)
B、c(CH3COO-) = c(Cl-) > c(CH3COOH) > c(H+)
C、c(CH3COO-) > c(Cl-) > c(CH3COOH) > c(H+)
D、c(CH3COO-) > c(Cl-) > c(H+) > c(CH3COOH)
15.下列反应的现象描述与离子方程式都正确的是 ( )
A、铁片投入稀盐酸中,有气泡逸出:Fe + 2 H+ + 2 Cl- → FeCl2 + H2↑
B、氯化钡溶液与硫酸反应,有白色沉淀产生:Ba2+ + SO42- → BaSO4↓
C、碳酸氢钠与盐酸反应,有气泡逸出:NaHCO3 + H+ → Na+ + H2O + CO2↑
D、过量铁粉与氯化铁溶液反应,溶液变成浅绿色:Fe + Fe3+ → 2 Fe2+
16.下列各项中的两个量,其比值一定为2 :l的是 ( )
A、在反应2 H2S + SO2 → 3 S + 2 H2O中被氧化与被还原的硫原子的质量
B、相同温度下,0.2 mol·L-1 CH3COOH溶液与0.1 mol·L-1 CH3COOH溶液中的c(H+)
C、在密闭容器中,N2+3H2
![]() 2NH3达平衡时的c(NH3)与c(N2)
2NH3达平衡时的c(NH3)与c(N2)
D、0.1 mol·L-1 Na2CO3溶液中的c(Na+)与c(CO32-)
17. 某无色溶液,由Na+、Ba2+、Al3+、AlO2-、Fe3+、CO32-、SO42-中的若干种组成。取适量该溶液进行如下实验:① 加入过量盐酸,有气体生成;② 在①所得的溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;③ 在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉淀乙析出。原溶液中一定存在的离子是 ( )
A、Al3+、Fe3+、SO42- B、Na+、AlO2-、CO32-
C、Na+、AlO2-、SO42-、CO32- D、Na+、Ba2+、AlO2-
三、选择题(本题共20分)每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分。
18. 下列反应属于吸热反应的是 ( )
A、氯酸钾分解制氧气 B、盐酸与氢氧化钠溶液混合
C、铁片投入稀盐酸中 D、氯化铵与消石灰混合制氨气
19.下列叙述正确的是 ( )
A、离子化合物中可能含有共价键 B、分子晶体中的分子内一定含有共价键
C、分子晶体中的分子内不会含有离子键 D、原子晶体中一定含有非极性共价键
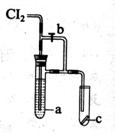
20.如右图所示装置,将少量干燥的Cl2通入,若打开活塞b,则小试管里的干燥品红试纸c不褪色,若关闭活塞b,则c不久即褪色,则a溶液是 ( )
|
|
B、浓硫酸
C、饱和食盐水
D、氢氧化钠溶液
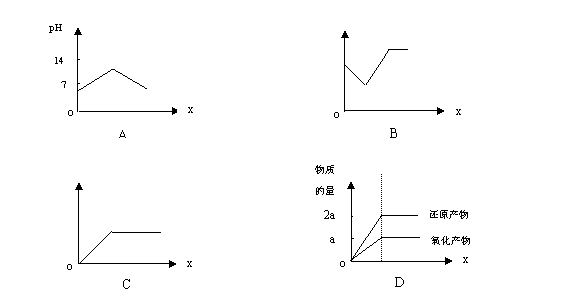
21.在一定量的H2S水溶液中逐渐通入Cl2,下列图像中所示的变化关系正确的是(x轴代表通入Cl2的物质的量) ( )
![]()
![]()

22.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种。现将13.8 g样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9 g沉淀。对样品所含杂质的正确判断是 ( )
A、一定含有KNO3 B、一定含有KNO3,可能含有Na2CO3
C、一定不含有Ba(NO3)2,可能含有KNO3 D、一定不含有Na2CO3和Ba(NO3)2
第Ⅱ卷(共84分)
四、(本题共23分)
 23.短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
23.短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):
已知: a.常见双原子单质分子中,X分子含共用电子对的数目最多。
b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是_____________________ 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
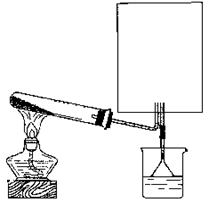
① 若用烧瓶收集甲,方框内的装置可用下图中的______仪器装置简图(气流方向均从左到右)。
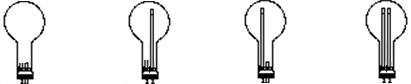 A.
B.
C.
D.
A.
B.
C.
D.
② 试管中的试剂是(填写化学式)___________________ 。
③ 烧杯中溶液由无色变为红色,其原因是(用电离方程式表示)
_______________________________________________________ 。
(3)单质Z可制得常用的消毒剂——漂粉精,请写出该反应的化学方程式:
_____________________________________________________________。
24.氮的化合物与人类关系很密切。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
_______
SiO2 + ______ C + ______ N2 ![]() ______ Si3N4 + ______ CO
______ Si3N4 + ______ CO
① 配平上述反应的化学方程式
② 该反应的氧化剂是___________________;
(2)氮的氧化物是常用的工业原料,但也是大气的主要污染物之一,综合治理其污染是环境化学当前的重要研究内容之一。
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g)→4NO(g) + CO2(g) + 2H2O(g)
CH4(g) + 4NO(g)→2N2(g) + CO2(g) + 2H2O(g)
若用标准状况下4.48L的 CH4气体还原NO2至N2,整个过程中转移的电子总数为___________(阿伏加德罗常数用NA表示)。
25.有A气体和B气体在一定条件下在一密闭容器中发生如下反应:
A(g)+ 3B(g)![]() 2C(g)+ Q(Q>0)
2C(g)+ Q(Q>0)
(1)写出该反应的化学平衡常数表达式K=______________________________。
(2)升高温度,该反应的正反应速率(v正)_________,逆反应速率(v逆)________,K值__________, 气体C的百分含量________________。(以上均填“增大”、“减小”或“不变”)
(3)若增大压强,A的转化率_________;若已达平衡后再加入A,A的转化率_________,C%_________。(以上均填“增大”、“减小”或“不一定”)
(4)若加压到10×101.3 KPa时,其它条件不变,发现平衡逆向移动,原因应该是______(填序号)
A.由于体积变大了,反应朝着体积增大方向移动
B.由于A状态发生了变化
C.由于体积变小了,反应朝着体积增大方向移动
D.由于A和B的状态都发生了变化
E.由于B状态发生了变化,A状态可能发生了变化也可能没有变化
(5)下图表示上述反应在某一时间段中反应速率与反应过程的关系图。由图判断,C的百分含量最高的一段时间是___________。
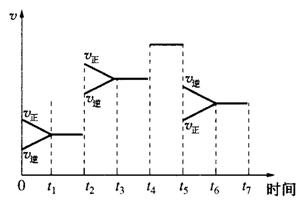
(6)据图判断反应在t2~t3这段时间内,曲线变化的原因是________,t5~t6时间内曲线变化的原因可能是________。(以上均填编号)
A.加了催化剂 B.扩大容器的体积 C.降低温度 D.增大压强
五、(本题共24分)
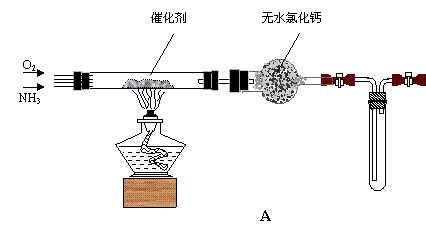
26.资料显示:“氨气可以在纯氧中燃烧生成无毒物质……”。某校化学兴趣小组学生设计如下装置进行氨气与氧气在不同条件下反应的实验。
(1)从下图中选择制取纯净、干燥氨气的合适装置:________________(填编号)。
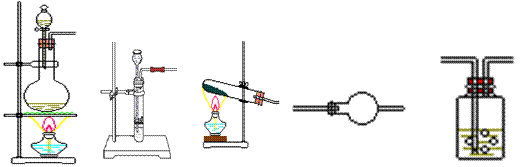
a b c d e
(2)先用酒精灯加热装置A中催化剂(铂丝)至红热,然后缓缓地通入氨气与过量的氧气。
 | |||
 | |||
①铂丝能保持红热的原因是 ;氨催化氧化的化学方程式是 ;无水氯化钙的作用是 ;
试管内气体变为红棕色,该反应的化学方程式是 。
②停止反应后,立即关闭A 中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请结合化学方程式,用有关理论说明原因
。
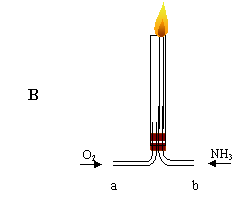
(3)将过量的氧气与产生的氨气分别从a、b两管进气口通入到装置B中,并在管上端点燃氨气。
①为了保证氨气一点就燃,应先通入的气体是 (填入化学式),其理由是
。
②氨气在纯氧中燃烧的化学方程式是 。
27.我国化学家侯德榜改进国外的纯碱生产工艺,生产流程可简要表示如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]() CO2
食盐水
X
CO2
食盐水
X
|
|
|
|
|
![]()
![]()
|
|
![]()
![]()
|
|
|
![]()
![]()
![]()
![]()
NaCl
(1)合成氨厂提供的CO2是制取原料氢气时产生的废气,写出合成氨厂制取氢气的化学方程式:__________________________________________________________。
(2)在沉淀池中放入一定量的饱和食盐水后,先通入足量的气体 (写化学式)再通入另外一种气体,原因是 ,在沉淀池中发生反应的总化学方程式是 __________。
(3)写出流程中操作名称:操作Ⅰ ;操作Ⅱ 。
(4)向母液中通入氨气,并且加入细小的食盐颗粒,冷却析出副产品,原理是 ______
________________________________________________。
通氨气的作用是 (填编号) 。
(A)增大NH4+的浓度,使NH4Cl更多地析出;
(B)使NaHCO3更多地析出;
(C)使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度。
(5)生产中可循环使用的物质是 (写化学式)。
(6)上述生产纯碱的方法称为 。
 |
六、(本题共20分)
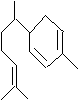
28.姜烯是姜的挥发油中的主要成分,其结构简式用“键线式”可表示为: 。
则:
(1)姜烯的分子式为______________。
(2)关于姜烯分子的说法错误的是__________。
a. 能使高锰酸钾溶液褪色 b. 1 mol 姜烯能与3 mol H2发生加成反应
c. 姜烯分子内含有3种官能团 d. 常温、常压下为气体
(3)1 mol 姜烯与1 mol Br2在一定条件下发生加成反应,其加成产物的结构简式为(写2种):_____________________、_______________________。
29. 有机物A为茉莉香型香料。
|
|
|
(1)A分子中含氧官能团的名称是______________。
(2)C的分子结构可表示为: Br Br O (其中R和R‘代表不同的烃基),
│ │ ‖
R─CH─C─ C─OH
│
R‘
A的分子式是_____________,A可以发生的反应是___________(填字母序号)。
a. 还原反应 b. 消去反应 c. 酯化反应 d. 水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R‘的有机物R’-OH的类别属于______________。
(4)A分子结构中只有一个甲基,A的结构简式是_____________________。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式为:
_________________________________________________________________。
(6)在A的多种同分异构体中,符合:①烃基R‘含有三个甲基;②其余部分均与A相同。这样的同分异构体有________种。
七、(本题共17分)
30. 由Fe2O3、CuO组成的混合物32 g溶于200 mL H2SO4溶液中,然后加入4 mol·L-1的NaOH溶液,开始无沉淀产生,随着NaOH溶液的加入沉淀量增多,当加入300 mL NaOH溶液时,恰好完全沉淀,则硫酸溶液的物质的量浓度是_________________。
31.硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2 NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2 ①
NO + NO2 + Na2CO3 → 2 NaNO2 + CO2 ②
(1)根据反应①,每产生22.4 L(标准状况下)CO2气体,吸收液质量将增加___________g。
(2)配制1000 g质量分数为21.2 %的纯碱吸收液,需要Na2CO3·10 H2O___________g。
(3)现有1000 g质量分数为21.2 %的纯碱吸收液,吸收硝酸工业尾气,每产生22.4 L(标准状况下)CO2气体时,吸收液质量就增加44 g。吸收液中NaNO2和NaNO3的物质的量之比为
___________________。
(4)已知1000 g质量分数为21.2 %的纯碱溶液在20℃经充分吸收硝酸工业尾气后,蒸发掉688 g水,冷却到0℃(0℃时,s(NaNO2)=71.2 g/100g水),最多可析出NaNO2______g。