08届高三化学第一学期期终考试模拟卷(五)
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每题3分,共24分。每小题只有一个选项符合题意)
⒈己知 CuS04 溶液分别与 Na2C03 溶液、Na2S 溶液的反应情况如下:
(1) CuS04 十 Na2C03 主要 : Cu2+ + C032- + H20 == Cu(OH)2 ↓十 CO2 ↑
次要 : Cu2+ + C032- == CuC03 ↓
(2) CuS04 + Na2S 主要 : Cu2+ + S2- == CuS ↓
次要 : Cu2+ + S2- + 2H20 == Cu(OH)2↓+ H2S ↑
下列几种物质的溶解度大小的比较中,正确的是
A. CuS <Cu(OH)2<CuC03 B. CuS >Cu(OH)2>CuC03
C. Cu(OH)2>CuC03>CuS D. Cu(OH)2<CuC03<CuS
⒉为证明CuSO4溶液显蓝色与Cu2+有关而与SO42-无关,某同学设计了下列实验,其中对实验目的没有意义的是:
①观察稀硫酸颜色 ②观察无水硫酸铜粉末颜色 ③稀释CuSO4溶液,观察溶液蓝色变化 ④往CuSO4溶液中滴加少量NaOH溶液,生成蓝色沉淀,过滤,观察滤液颜色变化⑤往CuSO4溶液中滴加足量BaCl2溶液,生成白色沉淀,过滤,观察滤液颜色变化
A.①②④ B.②③④ C.②③⑤ D.①④⑤
![]() ⒊金属钾的冶炼可采用如下方法:2KF+CaC2
CaF2+2K↑+2C。
下列有关说法合理的是:① 该反应的氧化剂是KF,氧化产物是K ② 该反应中每生成12gC转移的电子数为1mol ③ 该反应说明C的还原性大于K ④ CaC2、CaF2均为离子化合物,且阴阳离子个数比均为1∶2 ⑤ 可以用勒沙特列原理解释该反应进行的原因 ⑥ 这种冶炼方法是热还原法
⒊金属钾的冶炼可采用如下方法:2KF+CaC2
CaF2+2K↑+2C。
下列有关说法合理的是:① 该反应的氧化剂是KF,氧化产物是K ② 该反应中每生成12gC转移的电子数为1mol ③ 该反应说明C的还原性大于K ④ CaC2、CaF2均为离子化合物,且阴阳离子个数比均为1∶2 ⑤ 可以用勒沙特列原理解释该反应进行的原因 ⑥ 这种冶炼方法是热还原法
A.全部 B.只有② C.①②③④⑤ D.②⑤⑥
⒋按一定比例共熔两种硫酸盐可制得化合物X,X溶于水可电离出由K+、SO42-、Cr3+。将2.83gX中Cr元素全部氧化成Cr2O72-, Cr2O72-可从过量的KI溶液中氧化出3.81g I2,如果取溶有2.83g X的溶液,加入过量的BaCl2,可得4.66gBaSO4沉淀,则表示X组成的化学式为:①KCr(SO4)2 ②K2SO4·2Cr2(SO4)3 ③2K2SO4·Cr2(SO4)3 ④K2SO4·Cr2(SO4)3 ⑤K3Cr(SO4)3 ⑥KCr3 (SO4)3
A.①③ B.②④ C.①④ D.⑤⑥
⒌已知:N2(g)+3H2(g) ![]() 2NH3(g);△H
=-92.4kJ/mol,在相同温度下,向一密闭容器中通人0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol N2和1.5mol H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
2NH3(g);△H
=-92.4kJ/mol,在相同温度下,向一密闭容器中通人0.6mol N2、1.8mol H2和0.8mol NH3达平衡时反应的热效应(即放出或吸收的热量)为QlkJ;向另一体积相同的密闭容器中通入0.5mol N2和1.5mol H2、lmol NH3,达到平衡时反应的热效应为Q2kJ,则下列判断一定错误的是
①Q2<Ql ②Q1=Q2 ③Q1<Q2 ④Q2<92.4 ⑤Ql<92.4 ⑥Q2=Q1=92.4
A.⑥ B.②⑥ C.①④⑤ D. ①②③④⑤
⒍某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A(g)+3B(g)![]() 2C(g).若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10﹪,下列推断正确的是
2C(g).若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10﹪,下列推断正确的是
①原混合气体的体积为1.2升;②原混合气体的体积为1.1升;③反应达平衡时气体A消耗0.05V升;④反应达平衡时气体B消耗0.05V升。
A.②④ B.②③ C.①③ D.①④
⒎下列叙述一定正确的是
①Cu和足量的浓硝酸反应产生3.36L气体,则被还原的NO3-数目大于0.15 NA
②71g氯气通入足量的水中,反应中转移的电子总数约为NA
③电解精炼铜时转移0.1NA个电子,则阳极溶解了3.2 g铜
④Fe(NO3)2溶液中存在平衡:Fe2+ + 2H2O![]() Fe(OH)2
+2H+,加入少量稀盐酸后溶液浅绿色会加深
Fe(OH)2
+2H+,加入少量稀盐酸后溶液浅绿色会加深
 A.①②
B.②④
C.③
D.全错
A.①②
B.②④
C.③
D.全错
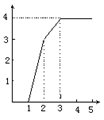
⒏某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如右图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
A.1∶1∶4 B.1∶3∶1 C.3∶3∶8 D.1∶1∶1
二、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个或两个选项符合题意。)
⒐能正确表示下列反应的离子方程式的是
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.少量固体Mg(OH)2溶于饱和NH4Cl溶液中:2NH4++Mg(OH)2=2NH3·H2O+Mg2+
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O ![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
⒑下列说法正确的是
A.pH=2的一元酸A和一元酸B,分别加入足量的镁粉,放出H2前者多,则A一定为弱酸,B可能为强酸
B.Li、Na、Mg、Al四种金属中的任三种混合,若1mol混合物与足量盐酸反应可放出1molH2,则其可能的组合只有二种:Li、Mg、Al的混合物或Na、Mg、Al的混合物
C.Fe和浓HNO3反应,若还原产物只有NO2生成,则溶液中的盐只有Fe(NO3)3
D.任意金属阳离子M m+和N n +,若氧化性M m+强于N n+,则金属性M弱于N
⒒锂电池用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯( ![]() )中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
)中形成的,以下电池的总反应方程式为:8Li+3SOCl2=6LiCl+ Li2SO3+2S,下列叙述中正确的是
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的负极,石墨作电池的正极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供电子的物质的量与析出硫的物质的量之比为4 :1
⒓某研究小组设计了如图所示的循环系统,来生产能解决能源危机的某种物质,其中所需的电能由太阳能光电池提供。
下面有关叙述正确的是
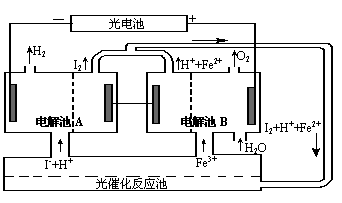 A.该循环系统的目的是制I2
A.该循环系统的目的是制I2
B.电解池A中离子反应方程式:
H2+I2![]() 2H++2I-
2H++2I-
|
为:2Fe3++2I-====2Fe2++I2
D.该系统中的Fe3+、H+、I-都是循
环使用的物质
⒔我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2 + NH3 + H2O + NaCl = NaHCO3↓+ NH4Cl的反应原理制备纯碱。下面是在实验室进行模拟实验的生产流程示意图:

则下列叙述错误的是:
A.A气体是NH3,B气体是CO2 B.第Ⅲ步得到的晶体是发酵粉的主要成分
C.第Ⅲ步操作用到的主要玻璃仪器是烧杯、漏斗、玻璃棒
D.第Ⅳ步操作的主要过程有溶解、蒸发、结晶
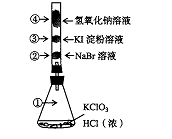 ⒕已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
⒕已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
⒖X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Z<Y<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
⒗某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| 盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
| 样品(g) | 3.32 | 4.15 | 5.81 | 7.47 |
| 二氧化碳的体积(mL) | 672 | 840 | 896 | 672 |
若另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生 CO2112mL(标准状况)和水0.45g。
下列描述中不正确的是
A.若用2.49g样品进行同样的实验时,产生CO2 504mL(标准状况)
B.该天然碱的化学式为2Na2CO3·NaHCO3·3H2O
C.实验中CO2体积V(mL)与样品质量W(g)之间的关系式为:0<W≤4.98 V(CO2)=202.4W(mL) ;4.98≤W≤12.45 V(CO2)=1680-134.9W(mL)
D.若12.45≤W ,V(CO2)=0 此盐酸的物质的量浓度为2.5mol·L-1
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共22分)
⒘(7分)某中学有甲、乙两个探究性学习小组,他们拟用一定质量的纯铝片与足量稀硫酸的反应测定通常状况(约20℃,101kPa)下气体摩尔体积的方法。
![]()
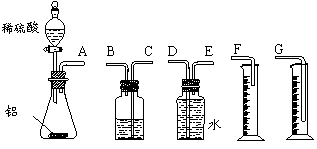 (1)甲组同学拟选用下列实验装置完成实验:
(1)甲组同学拟选用下列实验装置完成实验:
①该组同学必须选用的装置的连接顺序是
A接( )( )接( )( )接( )(填接口字母,可不填满。)
 ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。
。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶。请你帮助分析原因。
。
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?
____________________________________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如右图所示的实验装置。
装置中导管a的作用是 ______________________ ,
_______________________________________________________ _。
⒙(25分)A.学习了元素周期律后,同学们对第四周期过渡元素氧化物产生了浓厚的兴趣。是否只有二氧化锰能催化氯酸钾受热分解?氧化铁、氧化铜、氧化铬等对氯酸钾的受热分解有没有催化作用?对此他们进行了实验探究。请你根据要求完成下列部分实验报告。
I 课题名称:____________________________________________________________
II实验仪器及试剂:实验仪器:带铁夹的铁架台、带橡皮塞的导管、量气装置、过滤装置、电子天平、药匙、________、________、________等。
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
III 实验步骤:略
IV 实验数据:
| 实验 编号 | KClO3(g) | 氧化物 | 产生气体(mL) | 耗时(s) | ||
| 化学式 | 质量(g) | 回收 | (已折算为标况) | |||
| 1 | 0.60 | - | - | - | 10 | 480 |
| 2 | 0.60 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.60 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.60 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.60 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
V 实验讨论:(1)在氧化物的回收过程中,要进行过滤操作,所用的玻璃仪器是玻璃棒、_________、________
(2)实验编号3的实验中KClO3的分解率为_________%(保留一位小数)
(3) 在用Cr2O3 做研究实验时,发现有刺激性气味的气体产生,同时绿色的混合物变成了橘黄色。该刺激性气体是________(填分子式),可用______________试纸检验。上述异常现象产生的原因是___________________________________。
VI 实验结论:_____________________________________________________________
B.为测定碳酸钙纯度(设含杂质SiO2),同学们设计了如下几个实验方案,请回答每个方案中的问题。
[方案I]⑴称取碳酸钙样品 M g;⑵加入过量盐酸;⑶收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II]⑴称取碳酸钙样品 M g;⑵用c mol/L 盐酸 V mL(过量)溶解样品;⑶取溶解后的溶液V/10 mL,用c/ mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
[方案III](1)称取碳酸钙样品 M g;(2)把样品高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M/ g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV]⑴称取碳酸钙样品 M g;⑵加入足量c mol/L盐酸V mL使之完全溶解;⑶过滤并取滤液;⑷在滤液中加入过量c′mol/L Na2CO3溶液V′mL;(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M/ g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.c、V B.c′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′mL
B.精确配制浓度c′mol/L Na2CO3溶液
C.将步骤⑶所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤⑶所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤⑸中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
 方案
;
。
方案
;
。
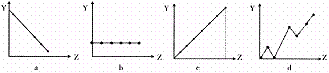
⒚(10分) ⑴下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性 质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
①ⅡA族元素的价电子数 ;
②第3周期元素的最高化合价 ;
③F-、Na+、Mg2+、Al3+的离子半径 。
⑵元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,B的化学式为 。
③工业上制取单质M的化学方程式为 。
⒛(8分)下图表示各物质之间的转化关系。已知:
Ⅰ.A是无色液体,L是不溶于稀硝酸的白色沉淀,E、F、H、J、X、Y、Z是气体;
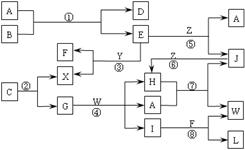 Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅱ.G、X、Y、Z是单质,其它是化合物,其中Y呈黄绿色、H呈红棕色,E和F都极易溶解于水,二者相遇会有白烟生成;
Ⅲ.B和C都是由一种金属与一种非金属元素组成的化合物,其中非金属元素相同且质量分数都是28%,组成B的金属元素原子核外的K层和M层电子数相同。
请按要求填空:
⑴写出下列物质的电子式:A________________,X________________;
⑵上述反应中属于置换反应的是________;不属于氧化还原反应的是__________;(填写反应代号)
⑶写出下列物质的化学式:B___________,C___________;
⑷反应④的离子方程式为:_____________________________________________。
21.(8分)将0.04molKMnO4固体加热一段时间后,收集到a mol气体,此时KMnO4的分解率为X。在反应后的残留固体中加入足量的浓盐酸,又收集到b mol气体(设Mn元素全部以Mn2+存在于溶液中)。试填写:
(1)a+b= (用X表示);
(2)当X= ,a+b取最小值且为 ;
(3)当a+b=0.09mol时,加热后所得残留固体的质量为 克。
22.(8分)I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)⇋Fe(s)+CO2(g) ΔH>0。其平衡常数可表达为k =c(CO2)/c(CO),已知1100℃时,k=0.263。
 (1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
(1)温度升高,平衡移动后达到新的平衡,高炉内CO2和CO的体积比值 (填“增大”“减小”或“不变”),平衡常数k值 (填“增大”“减小”或“不变”)。
(2)1100℃时测得高炉中c(CO2)=0.025mol∙L-1,c(CO)=0.1mol∙L-1,在这种情况下,该反应是否处于平衡状态 (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”“<”或“=”),原因是
II.如图所示,温度不变时,把某容器分割成A、B两部分,A容器 体积固定不变,B有可移动的活塞,现在A中充入2 mol
SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:2 SO2(g)+O2(g)
![]() 2 SO3(g)。根据下列要求填写空白:
2 SO3(g)。根据下列要求填写空白:
⑴固定活塞位置在3处不动,达到平衡时,设A中压强为PA , B中压强为PB,则PA与PB的关系是PA _____ PB(填“<”、“=”、“>”)。
⑵若要使A与B中平衡状态相同,可移动活塞的位置应在 处。
⑶若活塞右移到5处,达到平衡后,B中SO3为x mol,A中SO3为y mol , 则x和y 的关系是x y. (填“<”、“=”、“>”)。
23.(8分)(1)Xe和F2在一定条件下发生反应,Xe +F2 ![]() XeF2;XeF2+F2
XeF2;XeF2+F2![]() XeF4;XeF4+F2
XeF4;XeF4+F2![]() XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是
。
XeF6;可得XeF2、XeF4、XeF6三种气态氟化物。当压强一定,温度升高时,三种氟化物在平衡混合物中的浓度均减小。当压强为700kPa、温度达到1250℃时,测得XeF2的体积分数约为95%。那么,为了有效地制备XeF2,你认为应该采取的合适措施是
。
(2)据报道,在﹣55℃,将XeF4(X)和C6F5BF2(Y)化合,可得一离子化合物(Z),测得Z中Xe的质量分数为31%,阴离子为四氟硼酸根离子,阳离子结构中含有Y的苯环,Z是首例有机氙(Ⅳ)的化合物,﹣20℃以下稳定。Z为强氧化剂,如与碘反应得到五氟化碘,放出氙,同时得到Y。据此回答(要求化合物Z以离子形式表示):
①写出合成Z反应的化学方程式 。
②写出Z和碘反应的化学方程式 。
(3)英国化学家以巴特莱特将等物质的量的PtF6与Xe混合在室温下反应,制得第一个稀有气体化合物六氟合铂酸氙:Xe ﹢ PtF6 ﹦ XePtF6。该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等。已知生成物氙和氧气的物质的量之比为2﹕1、。试写出XePtF6水解反应的化学方程式 。
(4)现将二份等质量的XeF2和XeF4的混合物进行如下实验:
①一份用水处理,得到气体A和溶液B,A的体积为56.7mL(标准状况,下同),其中含O222.7mL,其余为Xe。B中的XeO3能氧化30.00mL浓度为0.1000mol∕L的(NH4)2Fe(SO4)2。(XeO3被还原为Xe)
②另一份用KI溶液处理,生成的I2用0.2000mol∕L的Na2S2O3溶液滴定,共用去35.00mL。已知反应 I2 + 2S2O32- == S4O62- + 2I- , 试求混合物中XeF2和XeF4的物质的量。
高三化学练习五参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | B | D | C | B | B | A | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | BC | C | B | D | D | A | AD | B |
17.(7分)(1)①EDG(或CBEDG)(2分)
②锌与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大(1分)
③待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况时的体积。(2分)
(2)使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下(1分);滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差(1分)。
18.A(12分)I 探究氧化铁、氧化铜、氧化铬对氯酸钾受热分解反应的催化作用(或二氧化锰、氧化铁、氧化铜、氧化铬催化能力的比较)。其他合理也给分 (1分)
II 大试管、酒精灯、计时器(或秒表) (3分);
V (1)普通漏斗;烧杯 (2分) (2) 40.8 (2分)
(3)Cl2;湿润的碘化钾淀粉试纸;KClO3与Cr2O3 发生了氧化还原反应 (3分)
VI 氧化铁、氧化铜、二氧化锰等都可作为KClO3受热分解的催化剂(或氧化铁的催化能力和二氧化锰的催化能力较好)。其他合理也给分(1分)
B(13分)方案Ⅰ:偏低(1分)
方案Ⅱ:①托盘天平(砝码)、药匙、酸式和碱式滴定管、锥形瓶(2分)
②B (1分)
方案Ⅲ: ①保证CaCO3完全分解 (1分)
②先在空气中适当冷却后再放进干燥器中冷却(1分)
方案Ⅳ:①A、B (2分) ②C (1分) ③偏高(1分) 方案Ⅱ(1分)
方案Ⅰ:气体体积难以准确测量(1分)
方案Ⅲ:实验室难以提供1000℃的高温(1分)
19.(10分)(1)①b ②c ③a(各1分,共3分)
⑵①HClO4(1分)②离子键、(极性)共价键(2分,各1分) NaClO(2分)
③SiO2+2C![]() Si+2CO↑(2分)
Si+2CO↑(2分)
20.(8分)⑴![]()
![]()
⑵ ③ ①⑧
⑶ Mg3N2 AgN3(每空1分)
⑷ Ag+2H++NO3-(浓)=Ag++NO2↑+H2O(2分)
21.(8分)⑴a+b=0.02x+0.1(1-x)+0.04x+0.02x=0.1-0.02x
(2)因为x≤1,当x=1时,a+b有最小值,(a+b)min=0.08
(3)当a+b=0.09时,0.1-0.02x=0.09,解得:x=0.5
加热后剩余固体的质量=m(KMnO4)-m(O2)
=0.04mol×158g/mol-0.02×0.5mol×32g/mol=6g
22.(8分) Ⅰ.(1)增大 增大 (2)否 >
[CO2]/[CO]=0.25<0.263,故平衡向正反应方向移动,v(正) > v(逆)
Ⅱ.(1)< (2) 3 (3) <
23.(8分)(1)降低投料F2 ∕Xe的比值(或增加Xe同时减少F2 )
(2)① XeF4 + C6F5BF2 ﹦C6F5XeF2+ + BF4-
② 5C6F5XeF2+ + 5BF4- +2I2 ﹦5C6F5BF2 + 4IF5 + 5Xe
(3)2XePtF6 + 6H2O = 2Xe↑ + O2↑ + 2PtO2 + 12HF
(4)(提示:由①求混合物中Xe的总物质的量为:2.02×10-3mol;设XeF2和XeF4的物质的量分另为x、y,则有:2x+4y=0.0035×2(电子得失守恒),x+y=2.02×10-3(Xe的总物质的量).求得:x=5.4×10-4 mol, y=1.48×10-3 mol