08届高三化学电化学单元练习
一、选择题(每题只有一个正确答案,每题三分,共21分)
1、已知蓄电池在充电时作电解池,放电时作原电池。铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“—”。关于标有“+”的接线柱,下列说法中正确的是 ( )
A.充电时作阳极,放电时作正极 B.充电时作阳极,放电时作负极
C.充电时作阴极,放电时作负极 D.充电时作阴极,放电时作正极
2、我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池,常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)![]() LaNi5+6Ni(OH)下列说法正确的是
( )
LaNi5+6Ni(OH)下列说法正确的是
( )
A. 放电时储氢合金作正极
B.放电时负极反应:LaNi5H6+6OH--6e- = LaNi5+6H2O
C.充电时阳极周围c(OH-)增大
D.充电时储氢合金作负极
3、下列是爱迪生电池分别在充电和放电时发生的反应:Fe + NiO2+2H2O![]() Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( )
Fe(OH)2+ Ni(OH)2下列对爱迪生蓄电池推断错误的是
( )
① 放电时,Fe参与负极反应,NiO2参与正极反应
② 充电时,阴极上的电极反应式为:Fe(OH)2 + 2e- = Fe + 2OH-
③ 放电时,电解质溶液中的阴离子向正极方向移动
④ 放电时,负极上的电极反应式为:Fe + 2H2O-2e- = Fe(OH)2 + 2H+
![]() ⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
⑤ 蓄电池的电极必须浸入某种碱性电解质溶液中
A.只有③ B.③④ C.④⑤ D.①②⑤
4、用电解水的方法分析水的组成时,需要加入一些电解质以增强水的导电性,不宜加入的物质是 ( )
A.Na2SO4 B.NaNO3 C.KOH D.CuSO4
5、若某电能与化学能的转化装置(电解池或原电池)中发生反应的总反应离子方程式是: Cu+2H+=Cu2++H2↑,则关于该装置的有关说法正确的是 ( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,电解质溶液不可能是盐酸
D.该装置只能是电解池,且金属铜为该电解池的阳极
|
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为:CH3OH
- 6e- + 8OH-![]() CO32-+6H2O
CO32-+6H2O
C.标准状况下,通入5.6LO2,并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入O2的电极附近溶液的pH降低
7、某溶液中含有两种溶质NaCl和H2SO4,它们的物质的量之比为31。用石墨作电极电解该混合溶液中,其电极产物可明显分为三个阶段。下列叙述不正确的是 ( )
A.阴极自始至终只析出H2 B.阳极先析出Cl2,后析出O2
C.电解最后阶段为电解水 D.溶液pH不断增大,最后为7
二、选择题(每题有一个或两个正确答案,全对得3分,共30分,少选得1分,错选、不选、多选得0分)
8、某甲烷—氧气燃料电池的结构如右下图所示,该电池的两个电极均由多孔碳制成,以30%KOH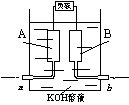 溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH
溶液为电解质溶液,气体由多孔碳孔隙逸出并在电极表面放电,其总反应的化学方程式为:CH4 + 2O2 + 2KOH![]() K2CO3 + 3H2O。下列说法中正确的是 ( )
K2CO3 + 3H2O。下列说法中正确的是 ( )
A.用多孔碳作电极,是为了增大气体与溶液的接触面积,加快气体的放电速率
B.若b处通入的气体为氧气,则B极为负极
C.当发生反应的O2为5.6L(标准状况)时,则有2mol电子发生转移
D.正极的电极反应为CH4
+ 10OH--8e-![]() CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
CO32- + 7H2O,放电一段时间后该极附近溶液 的pH降低
9、某学生设计了一种电解法制取Fe(OH)2的实验装置。通电后,溶液中产生大量白色沉淀,且较长时间不变色。下列说法中正确的是 ( )
A.电源中的a为正极,b为负极
B.不能使用NaCl溶液作电解液
C.A、B两端都必须使用铁作电极
D.B电极发生的反应为2H2O + 2e- = H2↑+ 2OH-
![]() 10、电脑右图是2004年批量生产的笔记本电脑所用的甲醇燃
料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 2CO2+
4H2O。下列说法正确的是
( )
10、电脑右图是2004年批量生产的笔记本电脑所用的甲醇燃
料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2 2CO2+
4H2O。下列说法正确的是
( )
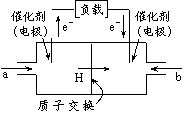 A.左电极为电池的负极,a处通入的物质是甲醇
A.左电极为电池的负极,a处通入的物质是甲醇
B.右电极为电池的负极,b处通入的物质是空气
![]() C.负极反应式为:CH3OH
+ H2O-6e- CO2 + 6H+
C.负极反应式为:CH3OH
+ H2O-6e- CO2 + 6H+
![]() D.正极反应式为:O2
+ 2H2O + 4e- 4OH-
D.正极反应式为:O2
+ 2H2O + 4e- 4OH-
11、用石墨电极电解500mLNaNO3和Cu(NO3)2的混合溶液。通电一段时间后,阴、阳两极逸出的气体在标准状况下的体积分别为11.2L和8.4L,求原溶液中Cu2+的物质的量浓度(假设溶液的体积不变) ( )
A.1.25 mol·L-1 B.2.5 mol·L-1 C.0.50 mol·L-1 D.1.0 mol·L-1
12、将羧酸的碱金属盐电解可生成烃类化合物,例如: 2CH3COOK
+ 2H2O![]() CH3—CH3↑+
2CO2↑+H2↑+2KOH,现充分电解CH2Cl—COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是
(
)
CH3—CH3↑+
2CO2↑+H2↑+2KOH,现充分电解CH2Cl—COOK水溶液,并加热电解后的水溶液,则下列说法中合理的是
(
)
A.在阴极放出的气体是CO2 B.加热后有不溶于水的油状物生成
C.混合液蒸干后得到的固体是KOH D.混合液蒸干后得到的固体是KCl
13、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似), 如Li、Mg;Be、Al;B、Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氯气。若用 已潮解的LiCl加热蒸干并可热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是 ( )
A.无色无味为电解生成的锂与水反应放出的氢气
B.电解前LiCl加热时已发生水解
C.电解时产生的无色气体是氧气
D.无色气体是阳极放出的Cl2与水作用生成
14、下图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关 说法中不正确的是 ( )
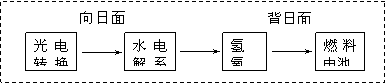 |
A.该能量转化系统中的水可以循环使用
B.燃料电池系统产生的能量实际上来自于水
C.水电解系统中的阳极反应:4OH-- 4e-![]() 2H2O + O2
2H2O + O2
D.燃料电池放电时的负极反应:H2
- 2e- + 2OH-![]() 2H2O
2H2O
15、高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH下列叙述不正确的是
A.放电时负极反应为:3Zn —6e—+6OH— == 3Zn(OH)2
B.放电时正极反应为:2FeO42—+6e—+8H2O===2Fe(OH)3+10OH—
C.放电时每转移3mol电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性减弱
16、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液加入0.2mol CuO,恰好恢复到电解前的浓度和pH。则电解过程中转移电子的物质的量为 ( )
A.0.1mol B.0.2mol C.0.3mo1 D.0.4mol
17、CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到。现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液。电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色。对阳极区溶液呈蓝色的正确解释是 ( )
A.2I--2e-=I2 碘遇淀粉变蓝
B.Cu-2e-=Cu2+ Cu2+ 显蓝色
C.2Cu+4I--4e-=2CuI↓+I2 碘遇淀粉变蓝
D.4OH――4e-=2H2O+O2 O2将I-氧化为I2,碘遇淀粉变蓝
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、本题共五小题,共49分
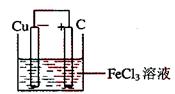
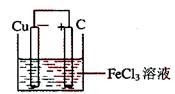
18、(15分) 铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ,负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 。
19、将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
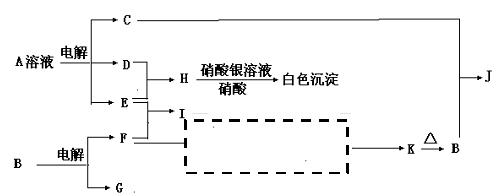 已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。
已知:构成两电极的金属的金属活泼性相差越大,电压表的读数越大。
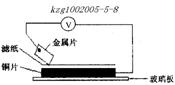
| 金属 | 电子流动方向 | 电压(V) |
| A | A→Cu | +0.78 |
| B | Cu→B | —0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
请依据表中数据判断:
(1)__________金属可能是最强的还原剂;__________金属一定不能从硫酸铜溶液中置换出铜。
(2)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上看到析出蓝色沉淀的是_________________(填字母)金属。其对应的原电池的电极反应式为:负极________,正极_____________。
20、已知B、C、D、K都是气体单质,物质A的焰色呈黄色,I为4核10电子中性分子,各有关物质之间的相互反应转化关系如下图所示,反应①--⑤ 都是用于工业生产的反应。

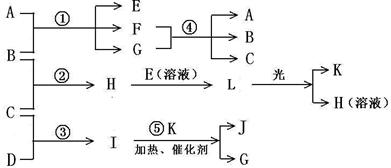
请填写下列空白:
(1)写出下列物质的化学式:B ,J 。
(2)写出下列反应的离子反应方程式:
H+E(溶液)→L ;
F+G →A+B+C 。
(3)若I与E以物质的量比1:2反应,得到F、G和二元素六核化合物M,则M的电子式是
。
(4) 反应④用于工业生产时目前采用如图示装置,该装置的优点有:
① ;
② 。
(5) 如图示装置(溶液体积为100mL), 其阴极的电极方程式是 , 标况下,当电极上产生112mL B气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH= 。
21、反应①②是重要的化工反应,D、E、F、G为单质,D、E、G、H为气体,且只有E为有色气
体,F是常见的金属单质,G是空气中主要成分之一,K是白色胶状沉淀,C的焰色反应为黄色,其物质间的转化关系如下,虚框内是需设计的内容,反应物只能用A~J中的物质:
(1)A的电子式 , H的结构式是 ;
(2)A溶液的电解方程式是 ;
C+B→J的离子方程式是 ;
 (3)请设计F→K的最佳途径
(3)请设计F→K的最佳途径
(4)按设计得到1mol K,电解B时转移的电子数目是 ,至少需要另加试剂的物质的量是
: mol, : mol, : mol(可不填满)。
22、目前世界上比较先进的电解制碱术是离子交换膜法。试回答下列问题:
(1)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-杂质,不符合电解要求,因此必须经过精制。
除去SO42-可用钡试剂,该钡试剂可以是 。(选填a、b、c)
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(2)现有200mL食盐水,其中含有少量的NaOH,该溶液的pH等于10,用石墨电极电解,当阴极产生的气体体积为0.224L(标准状况)时停止电解。
阳极的电极反应式为 。
电解后溶液的pH约为(忽略溶液的体积变化) 。
参考答案:
一、1、A 2 B 3 B 4 D 5 D 6 B 7 D
二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C
三、18、(1)2Fe3++Cu=2Fe2++Cu2+
 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。
②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
答案为:(1)C B
(2)B 2Cu-4e-==2Cu2+ 2H2O+O2+4e-==4OH-
20、1)Cl2、NO
(2)H++ClO-=HClO 2Cl-+2H2O = 2OH-+H2↑+Cl2↑
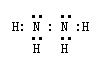 (3)
(3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。
(5) 2H2O+2e-=H2↑+2OH-, 13。
21、(1)![]() H—Cl
H—Cl
(2) 2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
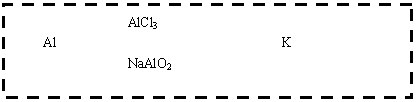 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
22、1)a c (2分)
(2)2Cl- - 2e- = Cl2↑(2分) 13 (3分
参考答案:
一、1、A 2 B 3 B 4 D 5 D 6 B 7 D
二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C
三、18、(1)2Fe3++Cu=2Fe2++Cu2+
 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。
②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
答案为:(1)C B
(2)B 2Cu-4e-==2Cu2+ 2H2O+O2+4e-==4OH-
20、1)Cl2、NO
(2)H++ClO-=HClO 2Cl-+2H2O = 2OH-+H2↑+Cl2↑
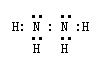 (3)
(3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。
(5) 2H2O+2e-=H2↑+2OH-, 13。
21、(1)![]() H—Cl
H—Cl
(2) 2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
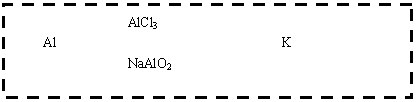 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
22、1)a c (2分)
(2)2Cl- - 2e- = Cl2↑(2分) 13 (3分
参考答案:
一、1、A 2 B 3 B 4 D 5 D 6 B 7 D
二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C
三、18、(1)2Fe3++Cu=2Fe2++Cu2+
 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。
②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
答案为:(1)C B
(2)B 2Cu-4e-==2Cu2+ 2H2O+O2+4e-==4OH-
20、1)Cl2、NO
(2)H++ClO-=HClO 2Cl-+2H2O = 2OH-+H2↑+Cl2↑
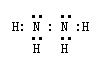 (3)
(3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。
(5) 2H2O+2e-=H2↑+2OH-, 13。
21、(1)![]() H—Cl
H—Cl
(2) 2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
22、1)a c (2分)
(2)2Cl- - 2e- = Cl2↑(2分) 13 (3分
参考答案:
一、1、A 2 B 3 B 4 D 5 D 6 B 7 D
二、8 A 9 AD 10AC 11C 12 D 13 BC 14 B 15 CD 16 D 17 C
三、18、(1)2Fe3++Cu=2Fe2++Cu2+
 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
19、 ①因构成两电极的金属活泼性相差越大,电压表读数越大,根据提供的数据和电子的流动方向,各金属的活泼性顺序:C>A>D>Cu>B。
②若用NaOH溶液作电解质,在滤纸上能看到有蓝色沉淀析出,则必须是Cu作该原电池的负极,即B组符合。
答案为:(1)C B
(2)B 2Cu-4e-==2Cu2+ 2H2O+O2+4e-==4OH-
20、1)Cl2、NO
(2)H++ClO-=HClO 2Cl-+2H2O = 2OH-+H2↑+Cl2↑
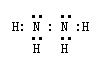 (3)
(3)
(4) ①氢气与氯气不混合,减小了危险性 ②可得到纯净NaOH溶液。
(5) 2H2O+2e-=H2↑+2OH-, 13。
21、(1)![]() H—Cl
H—Cl
(2) 2NaCl+2H2O=2NaOH+Cl2↑+H2↑、Al2O3+2OH—=2AlO2—+H2O
 (3)
(3)

(4)1.8×1024,HCl 0.25mol,NaOH 0.75mol
22、1)a c (2分)
(2)2Cl- - 2e- = Cl2↑(2分) 13 (3分