08届高三化学碱金属单元测试题
(第二章 碱金属)
考试时间:75分钟
班级_______________姓名__________________分数__________________
一、 选择题(每题3分,共48分,每题只有一个正确选项)
1.钠着火燃烧时,可用下列哪种物质灭火( )
①泡沫灭火器 ②干粉灭火器 ③水 ④沙土
A.①② B.④ C.②③ D.①②③
2.人们把食品分为绿色食品、蓝色食品、白色食品等。绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵制得的食品叫白色食品,下列食品属于白色食品的是( )
(A)食盐 (B)食醋 (C)面粉 (D)海带
3.用相同质量的金属钠进行下列实验,产生氢气的量最多的是:( )
A.将钠放入足量的盐酸溶液中
B.将钠用铝箔包好并刺穿一些小孔,放入足量的乙醇中
C.将钠用铝箔包好并刺穿一些小孔,放入足量的水中
D.将钠放入足量的硫酸铜溶液中
4.下列各项中的“黄色”,不属于因化学反应而产生的现象的是( )
A.无色试剂瓶中的浓硝酸呈黄色
B.蛋白质遇到浓硝酸颜色变黄
C.久置的碘化钾溶液呈黄色
D.食盐在无色的火焰上灼烧时,火焰呈黄色
5. 将等质量的①Na
②![]() ③
③![]() ④
④![]() ⑤Na2CO3·10H2O露置于空气中,最后质量由小到大的顺序是 ( )
⑤Na2CO3·10H2O露置于空气中,最后质量由小到大的顺序是 ( )
A.⑤<④<③<②<① B.①<②<③<④<⑤
C.⑤<④<②=③<① D.⑤<③<④<②<①
6.在密闭容器中充入CO2、CO、CH4的混合气体共mg,若加入足量的Na2O2,充分振荡并不断用电火花引燃至反应完全,测得固体质量增加mg;则CO2与CH4的体积比为
A.3:1 B.2:l C.1:1 D.缺少条件,无法计算
7.加热m g质量分数相等的Na2CO3和NaHCO3混合物,一段时间后,质量变为ng,当NaHCO3完全分解时,n值为( )
A. 53m/168 B. 137m/168 C. 53m/84 D.169m/168
8.有两种钾盐晶体混合物,分装在两支试管中,其中一支试管加热时有气体产生,另一支试管中加水时也有气体产生,这两种钾盐可能是( )
A.K2SO4和KHCO3 B.KHSO4和K2CO3 C.K2SO4和K2CO3 D.KHSO4和KHCO3
9.把含有少量的HCl、CO2、O2 的干燥的N2 气依次通过足量的过氧化钠与过量的灼热的铜丝,剩余的气体是( )
(A) 只有N2
(B) N2 与 HCl (g) (C) N2 和 O2 (D) N2、HCl、O2
10.有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3%
取1克该样品投入25毫升2摩/升的盐酸中后,多余的盐酸用1.0摩/升KOH溶液30.8毫升恰好完全中和,蒸发中和后的溶液可得到固体( )
(A)1克
(B)3.725克
(C)0.797克 (D)2.836克
11.周期表中有些元素有“隔类相似”现象(即对角线相似),如等,现用熔融LiCl电解,可得锂和氯气。若用已潮解的LiCl加热蒸干灼烧至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体,其主要理由是( )
(A)电解出的锂与水反应放氢
(B)电解前LiCl于加热时水解。
(C)电解时产生的无色气体是氯气
(D)在高温时阳极放出的氯与水作用释氧。
12.下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是 ( )
①金属性最强的是铯 ②氧化性最强的是锂原子 ③在自然界中均以化合态形式存在 ④密度按Li—Cs 顺序呈依次递增趋势 ⑤铯与水反应十分剧烈,甚至会发生爆炸 ⑥它们的氧化物都只有M20和M202两种形式 ⑦粒子半径:Rb+>K+>Na+,Cs>Cs+>K+, K>Na>Li
A.①②③④ B.④⑤⑥⑦ C.②⑥ D.①③⑤⑦
13.钾与氧组成的某种离子晶体,含钾的质量分数是![]() ,其阴离子只有过氧离子O
,其阴离子只有过氧离子O![]() 和超氧离子O
和超氧离子O![]() 两种,则此晶体中,O
两种,则此晶体中,O![]() 与O
与O![]() 的物质的量之比为 ( )
的物质的量之比为 ( )
A.2∶1 B.1∶1 C.1∶2 D.1∶3
14.某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将6.9g样品加入足量水,样品全部溶解.再加入过量的CaCl2溶液,得到4.5g沉淀.对样品所含杂质的正确判断是( )
A.肯定有KNO3
B.肯定有KNO3 Na2CO3
C.肯定没有Ba(NO3)2,可能有KNO3
D.肯定没有Na2CO3和Ba(NO3)2
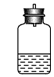 15.为了测定某碱金属M的相对原子质量,设计了如右图所示的装置。仪器本身连同水
15.为了测定某碱金属M的相对原子质量,设计了如右图所示的装置。仪器本身连同水
的质量为![]() 。若向瓶中投入
。若向瓶中投入![]() 金属M,实验完毕后,测得装置的质量为
金属M,实验完毕后,测得装置的质量为![]() 。
。
则计算碱金属M的相对原子质量的算式和实验值与正确值的比较分别是( )
A. ![]() 、偏小 B.
、偏小 B. ![]() 、偏大
、偏大
C.![]() 、偏大 D.
、偏大 D.![]() 、偏小
、偏小
16. 将过量CO2通入下列溶液中,最终没有沉淀产生的是 ( )
A、饱和NaOH溶液 B、饱和Na2CO3溶液 C、CaCl2 D、NaAlO2溶液
选择题答案表:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | ||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 |
二、填空题(共3小题,计28分)
1. (8分) 现有失去标签的四瓶无色溶液A.B.C.D,只知它们是K2CO3、K2SO4、NaHSO4和Ba(NO3)2,为鉴别它们,进行如下实验.
①A+D![]() 溶液+气体; ②B+C
溶液+气体; ②B+C![]() 溶液+沉淀;
溶液+沉淀;
③B+D![]() 溶液+沉淀; ④A+B
溶液+沉淀; ④A+B![]() 溶液+沉淀.
溶液+沉淀.
将④得到的沉淀物加入③所得的溶液中,沉淀很快溶解并产生无色无味的气体.根据以上实验事实,请回答如下问题:
(1)A.B.C.D四种无色溶液分别为:________、________、________、________.(用化学式表示)
(2)离子方程式为:①__________________
⑤___________________
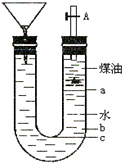 2.(10分)用右图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的密度为0.97g/mL,煤油的密度为0.87g/mL,请回答下列问题:
2.(10分)用右图的实验装置可以进行钠跟水的反应实验,并可收集、检验生成的气体。Na的密度为0.97g/mL,煤油的密度为0.87g/mL,请回答下列问题:
(1)液体物质添加完毕后,关闭活栓,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞,反应开始前钠的位置在_____处(填a、b、c);
(2)反应后,钠在煤油层和水层界面之间上下跳动,反应平缓连续进行。试说明产生上述现象的原因:
(3)写出Na跟水反应的离子方程式
(4)装置中的漏斗在反应过程中的主要作用是_______________;
(5)本实验除能使反应平缓连续进行、收集并检验气体外,还有一个优点是
。
这是因为___________________________________________ _。
3.(10分) 草木灰中含有碳酸钾,海草灰中含有碘盐,从草木灰中提取碳酸钾,
从海草灰中提取碘,并作有关检验操作:
(1)用石蕊试纸检验溶液的酸碱性,正确的操作方法
(2) 从草木灰中提取钾盐,过滤后的溶液在蒸发皿里加热以得到钾盐晶体,加热过程中要 ,当加热到
时停止加热。
(3)某学生用灼烧后的无锈铁丝沾上了钾盐,但在酒精灯上灼烧时看到火焰是黄色而看不到紫色,这是因为
(4) 将氯气通入海藻灰溶液,溶液变为浅棕色,将CCl4加入该溶液中,充分振荡静置
分层后,下层液体的颜色是
三.计算题(共2小题,计24分)
1.(10分)现有一种碱金属的碳酸正盐和另一种碱金属的酸式碳酸盐组成的混合物,取0.506g该混合物加热至质量不再发生变化为止。把放出的气体通入足量的澄清石灰水中,得到0.200g白色沉淀。把加热后残留的固体与足量稀硫酸充分反应,生成的气体经充分干燥后通过足量的过氧化钠粉末,结果过氧化钠粉末增重0.084g。问:
(1)混合物中酸式碳酸盐有_________g(不用写计算过程)
(2)加热灼烧后残留固体含碳酸盐___________g(不用写计算过程)
(3)通过计算,确定这两种盐的化学式,写出计算和推理过程。
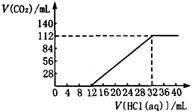 2.(14分)今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓慢滴加一定浓度的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到右图所示的曲线。试计算:
2.(14分)今有碱金属的两种碳酸盐组成的混合物6.14g,加水溶解后,取所得溶液的十分之一,向其中缓慢滴加一定浓度的盐酸,并同时记录放出CO2的体积(标准状况)和消耗盐酸的体积,得到右图所示的曲线。试计算:
(1)混合物中碳元素的质量分数。
(2)所滴加盐酸的物质的量浓度。
(3)确定这两种碱金属碳酸盐的化学式。
参考答案:
B B C D A C B D A B B D C A D C
1(1)K2CO3 Ba(NO3)2 K2SO4 NaHSO4
(2)①CO![]() +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
⑤BaCO3+2H+====Ba2++CO2↑+H2O
[1] (1)a
(2)当Na跟水反应剧烈时,H2气流将a托入煤油层,反应停止。随着H2气流减少,Na沉到煤油层和水层的界面,反应又进行。
(3)2Na+2H2O=2Na++2OH-+H2↑
(4)防止水溢出
(5)安全。此反应在隔绝空气下进行
3、(共8分)1) 将石蕊试纸放于玻片上,用玻棒蘸取待测液滴在石蕊试纸上
2) 用玻棒不断搅拌 有大量晶体出现(或少量水时)
3) 未透过蓝色钴玻璃 4) 紫红色
1。解:(1)0.4;(2)0.382;(3)碳酸钠和碳酸氢钾。
[1] (1)9.77%
(2)0.25mol/L
(3)讨论得出碱金属元素均为钾元素 K2CO3 KHCO3