08届高三化学碱金属单元测试题
考试时间:60分钟 命题人:丁建国
可能用到的相对原子质量: O 16 Cl 35.5 Ca 40 Mn 55
第Ⅰ卷(共48分)
一 选择题(每小题只有一个选项符合题意,每小题6分,共48分。)
1、下列科学家中,为我国化学工业作出重大贡献的是
A.邓稼先 B.李四光 C.华罗庚 D.侯德榜
2、下列有关钠的叙述中,错误的是
A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B.钠的化学性质非常活泼,钠元素只能以化合态存在于自然界
C.钠是一种灰黑色的固体
D.钠的质地软,可用小刀切割
3、在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3搅拌后静置,最终所得晶体的质量
A.等于1.06克 B.大于1.06克而小于2.86克
C.等于2.86克 D.大于2.86克
4、下列指定微粒的个数比为2∶1的是
A.Be2+离子中的质子和电子
B.![]() 2原子中的中子和质子
2原子中的中子和质子
C.NaHCO3晶体中的阳离子和阴离子
D.BaO2(过氧化钡)固体中的阴离子和阳离子
5、某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或二种.现将13.8克样品加入足量水,样品全部溶解,再加入过量的CaCl2溶液,得到9克沉淀。对样品所含杂质的判断正确的是
A.肯定有KNO3 B.肯定有KNO3,可能还含有Na2CO3
C.肯定没有Ba(NO3)2;可能有KNO3 D.肯定没有Na2CO3和Ba(NO3)2
6、NaH是—种离子化合物,它跟水反应的方程式为:NaH+H2O=NaOH+H2↑,它也能跟液氨、乙醇等发生类似的反应,并都产生氢气。下列有关NaH的叙述错误的是
A.跟水反应时,水作氧化剂 B.NaH中H-半径比Li+半径小
C.跟液氨反应时,有NaNH2生成 D.跟乙醇反应时,NaH被氧化
7、等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2物质的量之比为
A. 3∶4∶1 B. 3∶3∶2 C. 6∶7∶3 D. 6∶9∶0
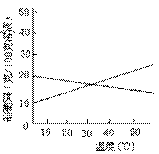 8、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
8、联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是
| 通入气体 | 温度控制 | |
| A | CO2 | 30~40℃ |
| B | CO2 | 0~10℃ |
| C | NH3 | 30~40℃ |
| D | NH3 | 0~10℃ |
第Ⅱ卷(共60分)
二 填空题
9、 (1)分别写出由氧气在一定条件下生成下列物质的化学方程式(必须注明反应条件)。
①O3:_______________________________________________________。
②Na2O2:___________________________________________________。
③Na2O:____________________________________________________。
(2)指出氧在下列各物质中的化合价:
O3_______________;Na2O2________________;Na2O_______________。
(3)KO2能吸收CO2生成K2CO3和O2,故可用作特殊情况下的氧气源,试写出该反应的化学方程式_____________________________________。
(4)人体内O2-离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式:
![]() □O2-+□H2O
== □H2O2+□O2+□
□O2-+□H2O
== □H2O2+□O2+□
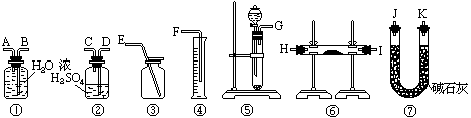 |
10、现有一定量含有Na2O杂质的Na2O2试样.请从下图中选用适当的实验装置,设计一个最简单的实验,测定Na2O2试样的纯度(可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水).
请填写下列空白:
(1)写出实验中Na2O2和Na2O分别发生反应的化学方程式.
、
(2)应选用的装置是(只要求写出图中装置的标号)
(3)所选用装置的连接顺序应是(填各接口的字母;连接胶管省略).
11、(04上海,26)某种含有少量氧化钠的过氧化钠试样(已知试样质量为1.560 g、锥形瓶和水的质量190.720 g),利用左图装置测定混合物中Na2O2的质量分数,每隔相同时间读得电子天平的数据如表:
| 读数次数 | 质量(g) | |
| 锥形瓶+水+试样 | 第1次 | 192.214 |
| 第2次 | 192.164 | |
| 第3次 | 192.028 | |
| 第4次 | 192.010 | |
| 第5次 | 192.010 |
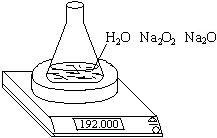
(1)写出Na2O2和H2O反应的化学方程式
(2)计算过氧化钠质量分数时,必需的数据是
不必作第6次读数的原因是
(3)测定上述样品(1.560 g)中Na2O2质量分数的另一种方案,其操作流程如下:
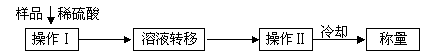 |
① 操作Ⅱ的名称是
② 需直接测定的物理量是
③ 测定过程中需要的仪器有电子天平、蒸发皿、酒精灯,还需要 、 (固定、夹持仪器除外)
④ 在转移溶液时,如溶液转移不完全,则Na2O2质量分数的测定结果 (填偏大、偏小或不变)。
12、(02广东,24)(12分)向300 mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L (标准状况下),得到11.9 g 的白色固体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
《碱金属》单元测试题参考答案
1D 2C 3D 4A 5A 6B 7A 8D
9、(10分)(1) ①3O2![]() 2O3
②2Na+O2
2O3
②2Na+O2![]() Na2O2 ③4Na+O2===2Na2O
Na2O2 ③4Na+O2===2Na2O
(2)0;-1;-2 (3)4KO2+2CO2=2K2CO3+3O2
(4)2 2 1 1 2 OH-
10、方法1:(1)2Na2O2+2H2O=4NaOH+O2↑,Na2O+ H2O=2NaOH
(2)⑤①④ (3)(G)接(A)(B)接(F)
方法2 :(1)2Na2O2+2CO2=2Na2CO3+O2,Na2O+CO2=Na2CO3 (2)⑤②⑥⑦①④
(3) (G)接 D.(C) 接 (H)(I)[或(I)(H)] 接(J)(K) 〔或(K)(J)〕 接(A)(B) 接(F) (方法2全答对也只有6分)
11、(1)2Na2O2+2H2O → 4NaOH+O2↑
(2)试样质量 锥形瓶加水的质量 第4(或5)次读数(或用具体数值表示)
锥形瓶内质量已达恒重
(3)①蒸发 ②NaCl的质量 ③烧杯 玻璃棒 ④偏大
12、(1)①K2CO3+KOH ②K2CO3 ③K2CO3+KHCO3 ④KHCO3
(2)白色固体中 ,K2CO3 质量为 6.90g,KHCO3质量为 5.00g
KOH 溶液物质的量浓度为0.500 mol•L—1