高三化学复习单元测试(2)—碱金属
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量: H:1 C:12 O:16 S:32 N:14 Cu:64 Fe:56 Ag:108
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题4分,共12题)
1.(2007年高考广东)下列说法正确的是( )
A.发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔
B.碘盐中的碘可以直接用淀粉检验
C.碳酸氢钠可用于治疗胃酸过多
D.硫酸氢钠属于盐类,其水溶液显中性
2. 向0.1mol·L-1NaOH溶液中通入过量CO2后,溶液中存在的主要离子是
A.Na+、CO![]() B.Na+、HCO3- C.HCO3-、CO
B.Na+、HCO3- C.HCO3-、CO![]() D.Na+、OH-
D.Na+、OH-
3.金属钠在空气中长久放置,最终生成物是
A. Na2O2 B. Na2O C. Na2CO3 D. NaOH
4. 将a g金属钠投入到b g水中(水过量),反应后所得溶液的质量分数是
A. a/(a+b) ´100% B. 40a/ (a+b) ´100% C. 20a/(a+b) ´ 100% D. 40a/(22a+23b) ´ 100%
5. (2007年高考全国理综卷II)在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol/L的HCl溶液中和,则该生成物的成分是( )
A. Na2O B. Na2O2 C. Na2O和Na2O2 D. Na2O2和NaO2
6.为确证NaHCO3固体中是否含Na2CO3,下列实验操作及判断正确的是
A. 观察加热时能否放出气体
B. 观察加盐酸时能否放出气体
C. 溶于水中,加入澄清石灰水,观察是否有白色沉淀生成
D. 溶于水中,滴加少量BaC12溶液,观察是否有白色沉淀生成
7.下列反应的离子方程式书写正确的是
A. 碳酸钠溶液跟盐酸混合CO32- + 2H+ == CO2↑+ H2O
B. 碳酸氢钠溶液跟石灰水混合 HCO3- + OH- = CO32-+ H2O
C. 碳酸氢钠溶液跟氢氧化钠溶液混合 H+ + OH- = H2O
D. 金属钠投入水中Na + H2O = Na+ + OH- + H2↑
8. 在稀溶液中下列离子能共存,且加人NaOH溶液有沉淀析出,加人盐酸有气体逸出的一组是
A. Na+、SO42-、Cu2+、Cl- B. Na+、Ca2+、Cl-、HCO3-
C. K+、Na+、NO3-、CO32- D. Ca2+、K+、SO42-、CO32-
9.某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种离子。向其中加入足量的Na2O2固体后,溶液中离子浓度基本保持不变的是(假设溶液的体积无变化)
A. CH3COO- B. SO32- C. CO32- D.HCO3-
10.在天平两托盘上分别放上质量相等的两只烧杯,在杯中分别加入等物质的量浓度、等体积的硫酸,些时天平处于平衡状态,然后分别向两只烧杯中加入等质量的无水碳酸钠和碳酸氢钠,最后天平两端的相对质量是
A.放NaHCO3的一端质量大 B.放Na2CO3的一端质量大
C.天平仍处于平衡状态 D.无法判断
11.向含0.14molNa2CO3的溶液中逐滴加入含一定量HCl的稀盐酸,经充分反应后,溶液中各溶质的物质的量判断可能正确的是
A.得0.2molNaCl和0.08molNaHCO3 B.剩0.04molNa2CO3,得0.20molNaCl
C.剩0.06molHCl,得0.14molNaCl和0.14molNaHCO3D.得0.06molNaCl和0.08molNaHCO3
12 .(2007年高考上海化学卷,碱金属)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+ 、Cl-、Mg2+、Ba2+、CO32 -、SO42 -,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04 mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是( )
A. K+一定存在 B. 100 mL溶液中含0.01 mol CO32 -
C. Cl-一定存在 D. Ba2+一定不存在,Mg2+可能存在
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
第Ⅱ卷(非选择题共60分)
13. (12分)下图中A至F是化合物,G是单质
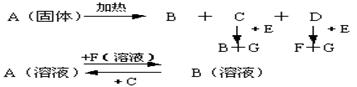
写出A、B、E、F的化学式A _____ B _____ E ______ F ____
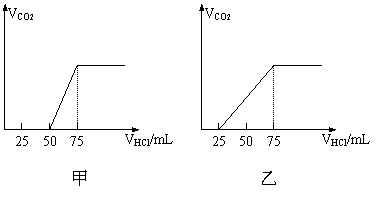 14.(18分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
14.(18分)有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液100mL,并向此稀稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标况)与所加入的盐酸的体积之间的关系如下图所示:
试分析NaOH在吸收CO2气体后,在甲所得溶液中存在的溶质是 ,
其物质的量之比是 ,产生的CO2气体体积(标况)是 。
乙所得溶液中存在的溶质是 其物质的量之比是 ,产生的CO2气体体积(标况)是 。
15.(06全国卷I28.)(16分)
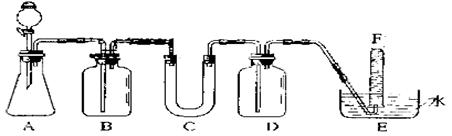
在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:_________ 。
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________________。
(4)试管F中收集满气体后,下一步实验操作是:__________________________.。
16.(2007年高考江苏卷)(14分)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
参考答案
第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 | C | B | C | D | C | D | A | B | A | B | A | A |
5. [答案]C。[提示]HCl为0.04 mol。钠的氧化物若为Na2O,应为0.02 mol×62 g·mol-1 = 1.24 g;若为Na2O2,应为0.02 mol×78 g·mol-1 = 1.56 g。现1.5 g,介于1.24~1.56之间,应为二者的混合物。
12. [答案]AC。[提示]据(2)知NH4+ 有0.04 mol。据(3)知:①BaSO4有2.33 g(即0.01 mol),即有0.01 mol SO42 -;②有BaCO3为3.94 g(即0.02 mol),即CO32 -有0.02 mol;③Ba2+、Mg2+不会存在。由于n(NH4+ )<2n(CO32 -)+2n(SO42 -),由电荷守恒可知,必有K+。
13. A NaHCO3 B Na2CO3 E Na2O2 F NaOH
14. 解析:NaOH溶液中通入一定量的CO2,有几种情况:一种情况是CO2不足,反应后的混合物为NaOH,Na2CO3;另一种情况是二者恰好完全反应生成Na2CO3;第三种情况是CO2过量,全部NaOH转化为NaHCO3;第四种情况是CO2过量,反应后的混合物为NaHCO3和Na2CO3。
分析甲图象:加入盐酸50mL时开始产生CO2气体,至反应完毕消耗25mL盐酸,根据反应:
Na2CO3+HCl=NaHCO3+NaCl ①
NaHCO3+HCl=NaCl+H2O+CO2↑②
可知滴加到50mL时开始反应②,根据耗酸量可知NaHCO3的物质的量。分析图象加入50mL以前,无气体放出,与盐酸反应转化为NaHCO3应消耗25mL盐酸,则与NaOH反应的盐酸也应是25mL。由此得也甲成分只能为NaOH和Na2CO3,且物质的量之比为1:1,产生CO2的体积为0.056L.
分析乙图象:加入盐酸25mL时开始产生CO2气体,消耗50mL盐酸反应完全,耗酸为末产生气体时的2倍,说明原物质是Na2CO3和NaHCO3的混合物,由耗酸量可判断出物质之比为1:1,产生气体亦可由产生气体耗酸量求得,为0.112L。
15. (1)![]()
(2)
| (饱和NaHCO3溶液) | 除去CO2气体中混入的HCl |
| 过氧化钠 | 与CO2和水气反应,产生O2 |
| NaOH溶液 | 吸收未反应的CO2气体 |
(3)![]()
(4)把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管。将带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
16. [答案](1)Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑, 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑。
(2)n(NaOH余) = 2.0 L×0.05 mol·L-1 = 0.1 mol,
n(H2) =![]() =0.05 mol,n(Al) =
=0.05 mol,n(Al) =![]() = 0.01 mol = n(NaAlO2),
= 0.01 mol = n(NaAlO2),
由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol = 2×0.05 mol,得:n(Na) = 0.07 mol。
由钠守恒知:n(NaAlO2)+n(NaOH) = n(Na)+2n(Na2O),即:0.01 mol+0.1 mol = 0.07 mol+2n(Na2O),
得:n(Na2O) = 0.02 mol。
w (Na)
=![]() ≈89%。
≈89%。