08届高三化学科(X)试题
命题人:宋子登
本试卷分选择题和非选择题两部分,共12页,满分150分;考试用时120分钟。
可能用到的相对原子质量: H 1 He 4 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
Cl 35.5 K 39 Ca 40 Fe 56 Cu 64 Br 80 Ag 108
第I卷(选择题,共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
 1.右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是
1.右图是同学们经常使用的某品牌修正液包装标签。小明仔细阅读后,结合自己的生活经验和所学知识得出了该修正液的某些性质,小明的推测中不合理的是
A.修正液是一种胶体,均一、透明
B.修正液中含有的化学物质有毒
C.修正液的成分对纸张不具有腐蚀性
D.修正液的溶剂易挥发、易燃
2.由解放军总装备部军事医学研究所研制的小分子团水,解决了医务人员工作时的如厕难题。新型小分子团“压缩”水,具有饮用量少、渗透力强、生物利用度高、在人体内储留时间长、排放量少的特点。一次饮用125mL小分子团水,可维持人体6小时正常需水量。下列关于小分子团水说法正确的是
A 水分子的化学性质改变 B 水分子中氧氢原子之间距离缩短
C 水分子间作用力减小 D 水分子间结构、物理性质改变
3.糖元(C6H10O5) n是一种式量比淀粉更大的多糖,主要存在于肝脏和肌肉中, 所以又叫动物淀粉和肝糖。下列关于糖元的叙述中正确的是
A.糖元与淀粉、纤维素互为同分异构体 B.糖元、淀粉、纤维素属于同系物
C.糖元水解的最终产物是葡萄糖 D.糖元具有还原性,能发生银镜反应
4.“非典型肺炎”在我国部分地区流行,严重危害广大人民的身体健康,做好环境消毒是预防“非典型肺炎”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-。下列有关说法中正确的是
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以单位体积得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为:Na2SO3+2NaClO3+H2SO4====2Na2SO4+2ClO2↑+H2O
5.据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1H原子核和2个电子构成。下列关于这种粒子的说法中,正确的是
A.它是氢的一种新同位素 B.这种新元素的核电荷数是3
C.它是H2的一种新同素异形体 D.它比一个普通氢分子多—个氢核
6.氯化氢的甲苯溶液(氯化氢气体与甲苯混合):
A、能导电 B、通入氨气产生白色沉淀
C、与Zn作用产生H2 D、与大理石作用产生气体
7.1999年美国《科学》杂志报道:在40GPa的高压下,用激光加热到1800K,人们成功制得了原子晶体CO2,下列对该物质的推断一定不正确的是
A.该原子晶体中含有极性键 B.该原子晶体易气化,可用作制冷材料
C.该原子晶体有很高的熔点、沸点 D.该原子晶体硬度大,可用作耐磨材料
8.配制一定体积,一定物质的量浓度的溶液时,下列哪种情况可能使溶液浓度偏小
A.容量瓶中原有少量蒸馏水 B. 滴管加水时,有少量水滴到容量瓶外
C.定容时观察液面俯视 D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
9.水是一种极弱电解质,在室温下平均每n个水分子只有一个分子发生电离,则n值是 A.1×10-14 B.55.6×107 C.107 D.55.6
10.海水淡化可采用膜分离技术。如右下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。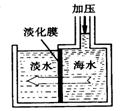 对加压后右侧海水成分变化分析正确的是
对加压后右侧海水成分变化分析正确的是
A.溶质质量增加 B.溶剂质量减少
C.溶液质量不变 D.溶质质量分数减少
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.2002年十大科技新闻之一是在世界各地9个研究所39名科学家通力合作下,欧洲核子研究中心成功地制造出约5万个低能量状态的反氢原子。已知反物质的主要特征是电子带正电荷,质子带负电荷。则以下可表示反物质酸与反物质碱进行中和反应实质的离子方程式是
 A.H- +OH+====H2O B. H-+OH-====H2O
A.H- +OH+====H2O B. H-+OH-====H2O
C.H+ +OH-====H2O D.H++OH+====H2O
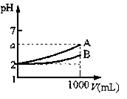
12.A、B两种酸溶液的pH都是2,各取1mL分别加水稀释成
1000 mL,其pH的变化如下图所示,则下列判断正确的是
A.原酸溶液的浓度cA=cB B.原酸溶液的浓度cA>cB
C.若a=5,则A为强酸,B为弱酸
D.若2<a<5,则A、B都是弱酸,酸性A>B
13.可逆反应 N2
+3 H2 ![]() 2NH3 是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1mol N2和3 mol H2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 mol NH3 ,达平衡时,吸收的热量为Q2。已知Q2 = 4Q1,则甲容器中,H2的转化率为
2NH3 是一个放热反应。有甲、乙两个完全相同的容器,向甲容器中加入1mol N2和3 mol H2,在一定条件下,达平衡时放出的热量为Q1;在相同条件下,向乙容器加入2 mol NH3 ,达平衡时,吸收的热量为Q2。已知Q2 = 4Q1,则甲容器中,H2的转化率为
A.20% B.25% C.75% D.80%
14.邻羟基苯甲酸,俗名水杨酸,其结构简式为![]() ,当与物质A的溶液反应生成化学式为
,当与物质A的溶液反应生成化学式为![]() 的盐,A可以是下列中的
的盐,A可以是下列中的
A.C6H5ONa B.Na2CO3 C.NaOH D.NaHCO3
15.下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL0.1 mol/L盐酸混合,
c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合,
c(Na+)=c(Cl-)>c(OH-)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合,
c(Na+)=c(CH3COO-)>c(OH-)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL1 mol/L盐酸混合,
c(Cl-)>c(Na+)>c(OH-)>c(H+)
16.下列离子方程式书写正确的是
A.等体积、等物质的量浓度的Ba(OH)2溶液与NaHCO3溶液混合:
Ba2++2OH-+2HCO3- ====BaCO3↓+CO32-+H2O
B.次氯酸钙溶液中通入少量SO2气体:
Ca2++2ClO-+SO2+H2O====CaSO3↓ +2HClO
C.NH4HCO3溶液与足量NaOH溶液混合:
NH4+ +HCO3-+ 2OH-==== NH3·H2O+CO32-+H2O
D.明矾溶液中加入过量的Ba(OH)2溶液:
2A13++ 3SO42- + 3Ba2++6OH-====3BaSO4↓+2Al(OH)3↓
17.石墨晶体为层状结构,层内每个碳原子以三个共价单链与其它碳原子连结合组成正六边形平面网状结构,则每层碳原子个数与碳碳单链数之比为
A.1:1 B.1:3 C.2:3 D.3:2
18.设NA表示阿伏加德罗常数,下列说法不正确的是
A.a g H2和b g He在同温同压时的体积比为a∶2b
B.2 L 0.1 mol/L的H2S溶液中,含有的H2S分子数小于0.2NA
C.78 g Na2O2与水充分反应,转移的电子数目为NA
D.1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA
19.三个烧杯分别盛CuCl2、KCl、AgNO3三种溶液,均以铂作电极,将它们串联起来电解一段时间后,测得电极总共增重2.5g ,这时产生有色气体与无色气体的体积比是(相同条件下的气体体积,且不考虑气体在水中的溶解)
A. 1∶ 1 B. 4∶ 3 C. 3∶ 4 D. 4∶ 1
20.如右图所示,一定条件下将1mol A2气体和3molB2气体充入一容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在恒温恒压下发生如下反应:
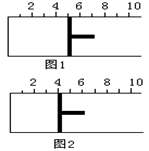
![]() A2(g)+3B2(g)2AB3 (g)。
A2(g)+3B2(g)2AB3 (g)。
当反应达到平衡时,活塞位置如图2所示,则平衡时A
的转化率是
A.20% B.60%
C.40% D.无法确定
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共28分)
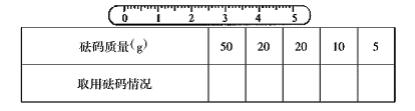
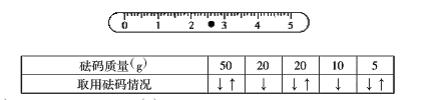
21.(6分)某同学用托盘天平称量一个小烧杯的质量,若小烧杯的质量为32.6g,用“![]() ”表示在天平上防砝码,用“
”表示在天平上防砝码,用“![]() ”表示从天平上取下砝码,请用箭头表示称量过程并填入下表中,并在游码尺上画出游码的位置(用“
”表示从天平上取下砝码,请用箭头表示称量过程并填入下表中,并在游码尺上画出游码的位置(用“![]() ”表示)
”表示)
22. (10分)指出在使用下列仪器(已经洗涤完毕)或用品时的第一步操作:
①蓝色石蕊试纸(检验某无色气体):____________ ___。
②250mL容量瓶:_______ _ _______。
③25mL酸式滴定管:______________ ___。
④集气瓶(收集氨气):_____________ ______。
⑤托盘天平:_____________ ______。
23.(12分)由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所法实验装置可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)a电极材料为_______,其电极反应式为_______________________。
(2)电解液d可以是_______,则白色沉淀在电极上生成;也可以是_______,则白色沉淀在两极之间的溶液中生成。
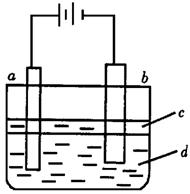
A.纯水 B.NaCl 溶液
C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是________________,在加入苯之前,对d溶液进行加热处理的
目的是_____________________。
(4)为了在短时间内看到白色沉淀,可以采取的措施是________________________。
A.改用稀硫酸做电解液 B.适当增大电源电压
C.适当缩小两电极间距离 D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为________________________________。
四、(本题包括2小题,共20分)
24.(10分)(1)若AgC1在水中、0.01 mol·L-1 CaCl2溶液中、0.01 mol·L-1 NaCl溶液中及0.05 mol·L-1AgNO3溶液中的溶解度分别为S1、S2、S3、S4,则S1、S2、S3、S4由大到小的顺序为 。
(2)下列曲线分别表示元素的某种性质与核电荷的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中:
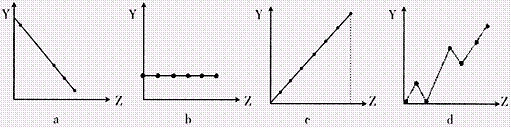 |
①ⅡA族元素的价电子数 ;
②第3周期元素的最高化合价 ;
③F-、Na+、Mg2+、Al3+的离子半径 。
(3)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4;M元素原子的最外层电子数与电子层数之比为4:3;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
①N的最高价氧化物的水化物的化学式为 。
②化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1:1:1,A溶液中水的电离程度比B溶液中水的电离程度小。则化合物A中的化学键类型为 ,
B的化学式为 。
③工业上制取单质M的化学方程式为
25.(10分)图示各物质间的转化关系中,A、B是两种正盐,均含有同一种非金属元素,A、B溶于水后得到混合溶液①。
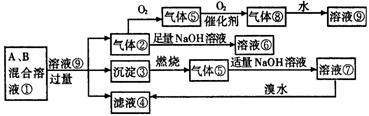
(1)写出下列反应的离子方程式:
②→⑥_____________________________________
⑦→④_____________________________________
(2)混合溶液①中的两溶质A、B可能存在多种组合,将其可能的组合中A和B的化学式及其物质的量nA、nB间应满足关系的数学表示式填入下表中(有几种情况填几种,可不填满也可补充):
| 组合 | A | B | nA与nB的关系 |
| Ⅰ | |||
| Ⅱ | |||
| Ⅲ |
五、(本题包括2小题,共22分)
26.(12分) 为清楚地看到无色NO遇空气变为红棕色(或浅棕色)的过程。某化学兴趣小组的甲、乙两位同学分别设计如下两个实验:
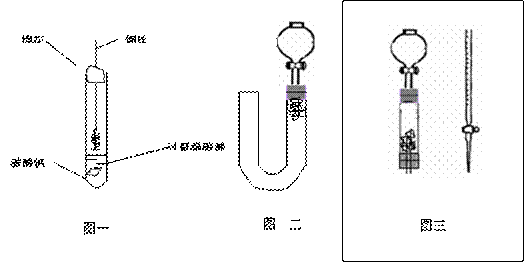
(1)甲同学实验如图一,步骤如下:①取大试管,放入适量大理石,加入过量稀硝酸②如图塞好疏松的棉花和铜丝③一段时间后,使铜丝浸入过量的硝酸反应④慢慢向试管底部推入棉花,可见明显现象。第①步放入大理石的作用是: 。
(2)乙同学则用图二装置,他的设想是这样:从分液漏斗注入稀硝酸,直到浸没铜丝,然后,关闭分液漏斗活塞, NO产生的压强将排开稀硝酸,达一定体积后,打开分液漏斗活塞,硝酸液体将NO气体压入空分液漏斗,在分液漏斗球部空间因接触空气而变色。但按他的方法实际操作的丙同学发现此法至少存在两个问题:
 ①当酸液加到浸没分液漏斗下端管口以后,会因为 而使后面的实验无法观察到预期现象。
①当酸液加到浸没分液漏斗下端管口以后,会因为 而使后面的实验无法观察到预期现象。
②反应开始后,因为随着NO的体积增加,由于 影响铜丝与硝酸的继续反应。
(3)丙同学将分液漏斗下端管口上提至与塞子下端齐平,解决了第①个问题,再用一个与U形管配套的单孔塞和另一个分液漏斗,仍用前述乙的仪器和思路,从左边顺利地将硝酸加到分液漏斗活塞处,请在左图中补齐装置并特别画出铜丝的适当位置:
(4)丁同学根据丙的思路,认为可以测定一下NO的体积并计算其产率(不考虑有其它气体),如果给你图三所示的仪器及一个酸式滴定管,用一根橡胶皮管将它们连接起来。为成功量取产生NO的体积,此实验中注入的硝酸在滴定管中至少应到达 ,设定有条件精确称量,还需要的数据是 。
(5)计算知:将等体积NO和O2通入倒置于水槽中的盛满水的试管中,充分反应后剩余气体的体积为原气体总体积的1/8,但准确的实验表明:余气体积比计算结果要大,实事求是的科学精神,要求我们应认真思考。已知氢氧化钠溶液可以吸收NO2,方程式为![]() ,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为
,氢氧化钠溶液可以吸收NO、NO2的混合气体,方程式为![]() ,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释.
,能否受此启发,写出可能发生的反应方程式,并对上述情况作一合理的解释.
27.(10分)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式 ;
。
(2)生产过程中操作B和D的名称均为 (B和D为简单操作)。
(3)反应中副产品a是 (用化学式表示)。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程中C物质可选用 。
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2
五、选做题(每小题10分,可任选一题做,若A、B都做,则以A题计分)
28(A).2005年诺贝尔化学奖授予三位在绿色化学领域有突出成就的科学家,绿色化学核心是实现零排放,而加成反应和化合反应实现了零排放。重氮甲烷在有机合成中有重要应用,可以用来合成甲醚、羧酸、酯类等重要有机产物。重氮甲烷的分子结构可以表示为 CH2—N≡N,在其分子中,碳原子和氮原子之间的共用电子对是由氮原子一方提供的。
(1)重氮甲烷的电子式为 。
(2)重氮甲烷在受热或光照时容易分解放出氮气,同时生成一个极活泼的缺电子基团亚甲基或称为碳烯(:CH2)。碳烯是一个反应中间产物,只能在反应中短暂存在,大约只能存在一秒钟。碳烯的电子式是 。
(3)碳烯很容易与烯烃、炔烃发生加成反应,生成三元环状化合物。碳烯与丙烯发生加成反应后所得产物的结构简式为 。
(4)碳烯还可以插入到C—H键,C—C键之间,使碳链加长,当它插入丙烷分子中C—H键之间,碳链增长后的化合物的结构简式为 或 。
(5)请分别写出碳烯与2—丁烯、苯反应的化学方程式(有机物用结构简式表示):
① ;
②
28(B).(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,C的非金属性最强,A、D同主族隔周期,E元素原子最外层的p亚层电子数是s亚层电子数的一半。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是________________ ,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是_____________ ________ __
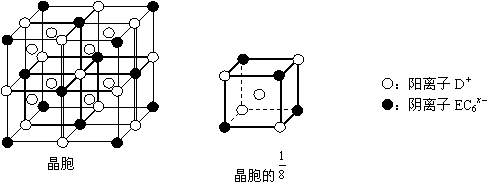
⑷C、D、E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。该化合物的化学式是_________ 。
(5)如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是
A.γ-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子有6个
C. 若δ-Fe晶胞边长为acm,α-Fe晶胞边长为bcm,则两种晶体密度比为2b3:a3
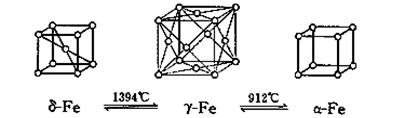 D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
![]()
![]()
 试题答卷
试题答卷
 21.(6分)
21.(6分)
22. (10分)
①____________ ___。
②_______ _ _______。
③______________ ___。
④_____________ ______。
⑤_____________ ______。
23.(12分)
(1)a电极材料为_______,其电极反应式为_______________________。
(2)电解液d可以是_______;也可以是_______。
(3)其作用是__________ 目的是________________ 。
(4) ______________________。
(5) _______________________________。
24.(10分)(1) 。
(2) ① ;② ;③ 。
(3) ① 。
② ,B的化学式为 。
③
25.(10分) (1) ②→⑥_____________________________________
⑦→④_____________________________________
(2)
| 组合 | A | B | nA与nB的关系 |
| Ⅰ | |||
| Ⅱ | |||
| Ⅲ |
26.(12分) (1) 。
(2)① 。② 。
 (3)
(3)
(4) , 。
(5)
27.(10分)
| |
。
(2) (3) (4)
(5) (6) 。
28(A).(10分)
(1)重氮甲烷的电子式为 。
(2)碳烯的电子式是 。
(3) 。
(4) 或 。
(5) ① ;
②
28(B).(10分)
⑴________________ ,__________________。
⑵__________。
⑶_____________ ________ __
⑷_________ 。
(5)
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | C | D | D | B | B | D | B | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| A | CD | A | AD | B | C | C | AD | B | C |
三、(本题包括2小题,共22分)
21.(6分)
22.⑴①用蒸馏水湿润试纸;②检漏;③检查活塞旋转是否灵活(检漏);④干燥。⑤将游码拨回零点,调零(各2分)
23.(12分) ①Fe;Fe-2e=Fe2+ (2分) ②C;B(2分)
③隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成的Fe(OH)2在溶液中氧化 (4分) ④B、C (2分) ⑤白色沉淀迅速变成灰绿色,最后变成红褐色(2分)
24.(10分)
(1)S1>S3>S2>S4(2分)
(2)①b ②c ③a(各1分,共3分)
(3)①HClO4(1分)②离子键、(极性)共价键(2分,各1分) NaClO(1分)
③SiO2+2C![]() Si+2CO↑(1分)
Si+2CO↑(1分)
25 (10分)(1)H2S+2![]() =S2-+2H2O (2分) SO
=S2-+2H2O (2分) SO![]() +Br2+H2O=SO
+Br2+H2O=SO![]() +2Br—+2H+(2分)
+2Br—+2H+(2分)
(2)Na2S,Na2SO3,![]() (3分) Na2S,Na2S2O3,
(3分) Na2S,Na2S2O3,![]() (3分)
(3分)
26. (12分)
(1)与稀硝酸作用生成CO2排出试管中的空气 (1分)
(2) ①如图二所示的铜丝所在空间中被封闭一段空气; (1分)
②产生的NO排开酸液而与大部分铜丝脱离接触。(1分)
 (3)(2分)正确画出如右图得2分。左边下端漏斗口露出橡皮塞也正确。若左边画一普通漏斗,亦给分。
(3)(2分)正确画出如右图得2分。左边下端漏斗口露出橡皮塞也正确。若左边画一普通漏斗,亦给分。
![]() (4)酸式滴定管最大量程刻度处。铜丝反应前后的质量(4分)
(4)酸式滴定管最大量程刻度处。铜丝反应前后的质量(4分)
![]()
![]() (5) (3分)
(5) (3分)
在此反应条件下,氮氧化物(NO、![]() )的最终产物并非HNO3一种,实际存在着较低价态的
)的最终产物并非HNO3一种,实际存在着较低价态的![]() ,实际消耗氧气的量将要减少。
,实际消耗氧气的量将要减少。
(答出一条以上反应,讲出耗氧量减小的意思,都给满分。)
27.(10分)
(1)Al2O3+6H+=2Al3++3H2O, 2Al+6H+=2Al3++3H2↑ (2分,各1分)
(2)过滤(1分) (3)H2 (1分) (4)HCl(2分)
(5)促进AlCl3水解,使晶体析出。(2分) (6)BD(2分,少一个扣一分,扣完为止)
28(A)(10分)略
28(B).(10分)(1)⑴![]() (1分) 第二周期、第ⅦA族
(2分)
(1分) 第二周期、第ⅦA族
(2分)
⑵ Na+ (1分)
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分) ⑷ Na3AlF6
(2分)
(5) B C(2分,选1个且正确的给1分,错选一个该题0分,)