高三化学复习单元测试(4)—卤素
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分108分.考试时间:60分钟.可能用到的原子量:H:1 He:4 C:12 O:16 S:32 N:14 Cl:35.5 K:39 Na:23 Ca:40 Al:27
第Ⅰ卷(选择题,共48分)
一、选择题(每小题只有一个选项符合题意,每小题6分,共8题)
1.(2007年高考广东化学卷)许多国家十分重视海水资源的综合利用。不需要化学变化就能够从海水中获得的物质是( )
(A)氯、溴、碘 (B)钠、镁、铝 (C)烧碱、氢气 (D)食盐、淡水
[答案]D
2.(2007年高考广东化学卷)氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
(A)若管道漏气遇氨就会产生白烟 (B)该反应利用了Cl2的强氧化性
(C)该反应属于复分解反应 (D)生成1 mol N2有6 mol电子转移
[答案]C。
3.(06上海化学14.)下列物质能通过化合反应直接制得的是
①FeCl3 ②H2SO4 ③NH4NO3 ④HCl
A.只有①②③ B.只有②③ C. 只有①③④ D.全部
4.某城市以“液氯泄漏”作为应急预警演习的项目,演习时下列防护措施合理的是( )
①及时向上风口和地势较高处转移疏散人群;②及时戴上用浓烧碱溶液湿润过的口罩;③用高压水枪向泄露口附近喷洒稀碱液并设法控制氯气泄漏;④及时戴上用稀纯碱溶液湿润过的口罩;⑤及时用毛巾包裹活性炭捂住口鼻;⑥就近向地下商场转移。
A.②③④⑤ B.①②④⑤ C.①③④⑤ D.①③④⑥
5.实验室用浓盐酸与二氧化锰反应制取氯气,下列有关说法中正确的是( )(气体体积在标准状况下测定)
A.若提供0.4 mol HCl,MnO2不足量,则可制得氯气2.24 L
B.若提供0.4 mol HCl,MnO2过量,则可制得氯气2.24 L
C.若有0.4 mol HCl参与反应,则可制得氯气2.24 L
D.若有0.4 mol HCl被氧化,则可制得氯气2.24 L
6.下列关于氯水的叙述,正确的是( )
A.新制氯水中只含Cl2和H2O分子 B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2 D.氯水放置数天后PH值将变大
7.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙黄色;再向橙黄色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出。该溶液可能大量存在的一组离子是( )
A.K+、H+、NO3-、Na+
B.H+、Br-、SO![]() 、Na+
、Na+
C.SO![]() 、Br-、OH-、Fe3+
D.H+、Br-、SO
、Br-、OH-、Fe3+
D.H+、Br-、SO![]() 、K+
、K+
8. 实验室制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在烧瓶中加入二氧化锰粉末 ④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中 ⑤用向上排空气法收集氯气,尾气导入吸收剂中
A ①②③④⑤ B ④③①②⑤ C ①③④②⑤ D ①④③②⑤
第I卷答题表 班考号 姓名
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
第Ⅱ卷(非选择题共60分)
9.(2007年高考理综四川卷)(18分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
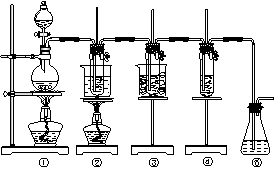
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:________________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
| 然后溶液从无色逐渐变为_______色 | _______________________________ |
10.(05天津26.)(18分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
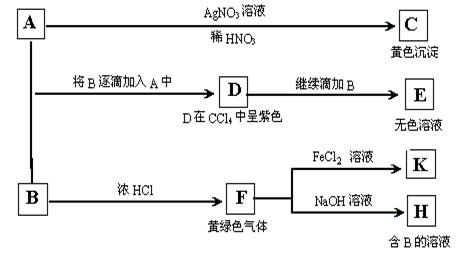
请回答:⑴ 出A、B和C的化学式:A_______________,B______________,C____________。
⑵ 依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
___________________________________;_____________________________________。
⑶ 写出将SO2气体通入K溶液发生反应的离子方程式:______________________________。
⑷ 写出由F→H的化学方程式:____________________________________________。
11.(2007年理综北京卷)(15分)市场销售的某种食用精制盐包装袋上有如下说明:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50 mg/kg |
| 分装日期 | |
| 分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是____________________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;b.加入适量Na2SO3稀溶液;c.分离出下层液体。
以上设计中遗漏的操作及上述步骤中的位置是____________ 。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________________________________。
②b中反应所产生的I2的物质的量是________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________________mg/kg。
12.(2007年高考上海化学卷) (9分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 。
(2)所得溶液中Cl-的物质的量为 mol。
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
高三化学复习单元测试(4)—卤素参考答案
第Ⅰ卷(选择题,共48分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | D | C | D | C | C | B | B | C |
9. [答案](1)分液漏斗;B。 (2)碱溶液(或反应物)的浓度不同,反应温度不同; 过滤。
(3)Cl2+2OH- = ClO-+Cl-+H2O。 (4)
| 红 | |
| 氯气与水反应生成HClO将石蕊氧化为无色物质 | |
| 黄绿 | 继续通入的氯气溶于水使溶液呈黄绿色 |
10. ⑴ NaI NaClO AgI
⑵ 2I— + ClO— + H2O == I2 + Cl— + 2OH— I2 + 5ClO— + 2OH— == 2IO3—+ 5Cl— + H2O
⑶ 2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42— + 4H+ ⑷ Cl2 + 2NaOH == NaCl + NaClO + H2O
11. [答案](1)1、5、3、3、3、3。
(2)①I2+SO32 -+H2O = 2I-+SO42 -+2H+;②在步骤b后,增加操作:将分液漏斗充分振荡后静置。
(3)①溶液由蓝色恰好变为无色。 ②1.0×10-5。
③![]() 。
。
[提示](3)③食盐中碘以KIO3形式存在,b中反应所产生的I2中只有1/5是来自于KIO3。要注意单位是mg/kg。
12. [答案](1)10.7%。 (2)0.25。 (3)3:2。