08届高三化学卤素单元测试题
考试时间:60分钟 命题人:丁建国
可能用到的相对原子质量: O 16 Cl 35.5 Ca 40 Mn 55
第Ⅰ卷(共48分)
一 选择题(每小题只有一个选项符合题意,每小题4分,共48分。)
1、下列说法正确的是
A.漂白粉的有效成份是氯酸钠 B.氯化氢在空气中呈现白雾,这种白雾有剧毒
C.碘化钾水溶液能使淀粉变蓝 D.氟气通入水中有氧气生成
2、随着卤素原子半径的增大,下列递变规律正确的是
A.单质的熔沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
3、检验氯化氢气体中是否混有Cl2,可采用的方法是
A.用干燥的蓝色石蕊试纸 B.用干燥有色布条
C.将气体通入硝酸银溶液 D.用湿润的淀粉碘化钾试纸
4、将下列物质分别加入溴水中,溴水颜色不变浅的是
A.KCl晶体 B.H2S气体 C.CCl4 D.Mg
5、为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中的碘以碘酸钾(KIO3)形式存在.已知在溶液中IO3-可和I-发生反应:IO3-+5I-+6H+=3I2+3H2O根据此反应,可用试纸和一些生活中常见的物质进行实验,证明在食盐中存在IO3-.可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒.进行上述实验时必须使用的物质是
A.①③ B.③⑥ C.②④⑥ D.①②④⑤⑦
6、冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:
Cl+O3→ClO+O2 ,ClO+O→Cl+O2下列说法不正确的是
A.反应后将O3转变为O2 B.Cl原子是总反应的催化剂
C.氟氯甲烷是总反应的催化剂 D.Cl原子反复起分解O3的作用
7、实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置 ③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A.②③④⑤ B.①②③④⑤ C.②③①④⑤ D.②①③④⑤
8、碱金属与卤素所形成的化合物大都具有的性质是
① 高沸点 ② 能溶于水 ② 水溶液能导电 ④ 低熔点 ⑤ 熔融状态不导电
A.①②③ B.③④⑤ C.①④⑤ D.②③⑤
9、碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是
A.I2O3 B.I2O4 C.I4O7 D.I4O9
10、下列单质中,最容易跟氢气发生反应的是
A.O2 B.N2 C.F2 D.Cl2
11、将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是
A.Mg、AlCl3、NaAlO2 B.KNO3、NaCl、CH3COONa
C.NaClO、Na2SO3、BaCl2 D.Ba(NO3)2、FeSO4、NH4HCO3
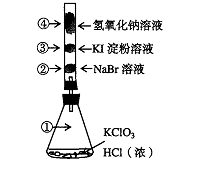 12、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
12、已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
| ① | ② | ③ | ④ | |
| A | 黄绿色 | 橙色 | 蓝色 | 白色 |
| B | 无色 | 橙色 | 紫色 | 白色 |
| C | 黄绿色 | 橙色 | 蓝色 | 无色 |
| D | 黄绿色 | 无色 | 紫色 | 白色 |
第Ⅱ卷(共60分)
二 填空题
13、(15分)(1) 1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
ŽK2MnF6+ŽSbF5 ¾ ŽKSbF6+ŽMnF3+ŽF2
反应中 元素被还原。
(2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)类似,化学上称为拟卤素
[如:(SCN)2+H2O![]() HSCN+HSCNO],它们阴离子的还原性强弱为:
HSCN+HSCNO],它们阴离子的还原性强弱为:
Cl-<Br-<SCN-<I-,试写出以下的反应式:
① (CN)2与KOH溶液反应的化学方程式
② NaBr和KSCN的混合物中加入(CN)2的离子方程式:
14、(15分)已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式:
。
(3)写出④中反应的化学方程式:
。
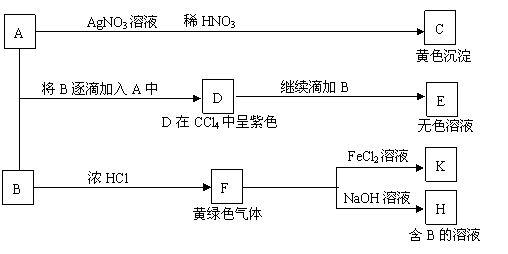 15、(15分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
15、(15分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
请回答:
(1)出A、B和C的化学式:A_______________,B______________,C____________。
(2)写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
A→D ;
D→E 。
(3) 写出将SO2气体通入K溶液发生反应的离子方程式:
。
(4)写出由F→H的化学方程式:
。
16、(15分)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200 mL 12 mol/L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气.分析实验结果发现:①甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。
试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2 克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
①
②
《卤素》单元测试题参考答案
1 D 2 B 3 D 4 A 5 B 6 C 7 D 8 A 9 D 10 C 11B 12 A
13、(1)2 4 4 2 1 (说明:错一个即不给分) (3分) Mn(或锰)(2分)
(2)(CN)2+2KOH=KCN+KCNO+H2O (5分)
2SCN-+(CN)2=2CN-+(SCN)2 (5分)
14、(1)Cl(或氯)K(或钾) (5分)
(2)Cl2+2KOH=KCl+KClO+H2O(5分)
(3)2KClO3![]() 2KCl+3O2↑(5分)
2KCl+3O2↑(5分)
15、
(1)NaI NaClO AgI (每空1分,共3分)
(2)2I-+ClO-+H2O=I2+Cl-+2OH-(3分)
I2+5ClO-+2OH-=2IO3-+5Cl-+H2O(3分)
(3)2Fe3++SO2 +2H2O=2Fe2++SO42-+4H+(3分)
(4)Cl2+2NaOH=NaCl+NaClO+H2O(3分)
16、(1)m[Ca(ClO)2] = 143 g/mol × 0.1 mol = 14.3 g(5分)
(2)①随着反应进行,温度升高,会产生副产物Ca(ClO3)2;(2分)
6Cl2+6Ca(OH)2 △ 5CaCl2+Ca(ClO3)2+6H2O(3分)
②Cl2未与石灰乳完全反应,残余Cl2被NaOH溶液吸收(2分)
Cl2+2NaOH=NaCl+NaClO+H2O(3分)
高三( )班 学号 姓名 分数
《卤素》单元测试题答题卡
一 选择题(每小题只有一个选项符合题意,每小题4分,共48分。)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| 答案 |
二 填空题
13、(15分)(1) ŽK2MnF6+ŽSbF5 ¾ ŽKSbF6+ŽMnF3+ŽF2 元素被还原。
(2) ①
②
14、(15分)(1)X是 ,Z是 。
(2) 。
(3) 。
15、(15分) (1)A_______________,B______________,C____________。
(2) A→D ;
D→E 。
(3) 。
(4) 。
16、(15分) (1)最多可制得Ca(ClO)2 克?
(2)①
②