2008届高三基本概念基本理论专题测试卷
可能用到的相对原子质量:H—1 C—12 O—16 P-31
一、选择题(每小题只有一个选项符合题意,每小题3分,共30分)
1. 2007年3月21日,我国公布了111号元素Rg的中文名称。该元素名称及所在周期:
A.钅仑 第七周期 B.镭 第七周期 C.铼 第六周期 D.氡 第六周期
2.请你运用所学的化学知识判断,下列有关化学观念的叙述错误的是
A 几千万年前地球上一条恐龙体内的某个原子可能在你的身体里
B 用斧头将木块一劈为二,在这个过程中个别原子恰好分成更小微粒
C 一定条件下,金属钠可以成为绝缘体
D 一定条件下,水在20℃时能凝固成固体
3.下列离子方程式书写正确的是( )
A.实验室用消石灰和氯化铵加热制氨气 ![]()
B.磷酸二氢钾溶液中加入足量的氢氧化钡 ![]()
C.硝酸亚铁溶液中滴入HF酸溶液 ![]()
D.![]() 溶液与
溶液与![]() 溶液反应
溶液反应 ![]()
4. 有关晶体的下列说法中正确的是 ( )
A 晶体中分子间作用力越大,分子越稳定 B 原子晶体中共价键越强,熔点越高
C 冰融化时水分子中共价键发生断裂 D 氯化钠熔化时离子键未被破坏
5.已知下列元素的半径为:
| 原子 | N | S | O | Si |
| 半径r/ | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷原子的半径可能是( )
A.0.80×![]() B.1.10×
B.1.10×![]() C.1.20×
C.1.20×![]() D.0.70×
D.0.70×![]()
6.最近科学研究表明,用氯气杀灭自来水中的病菌并非良好方法,氯胺(![]() )在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是( )
)在中性或酸性条件下是一种更好的强消毒剂,氯胺的消毒原理之一是( )
A.![]() B.
B.![]()
![]()
![]()
C. ![]() D.
D.![]()
![]()
![]()
7.从海水中提取溴有如下反应:![]()
![]() ,与上述反应在氧化还原原理上最相似的是( )
,与上述反应在氧化还原原理上最相似的是( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
8. 对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等 B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等 D.若体积相等,则密度相等
![]() 9.一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生如下反应:X(g)+Y(g)
mZ(g)+nR(g),达到平衡时Z的体积分数为
9.一定温度下,向一个一定容积的密闭容器中放入2molX和3molY,发生如下反应:X(g)+Y(g)
mZ(g)+nR(g),达到平衡时Z的体积分数为![]() ,维持温度不变,若把3molX和2molY放入另一体积相同定容的密闭容器,达平衡时,Z的体积分数为
,维持温度不变,若把3molX和2molY放入另一体积相同定容的密闭容器,达平衡时,Z的体积分数为![]() ,则
,则![]() 和
和![]() 关系为( )
关系为( )
A.![]() <
<![]() B.
B.![]() >
>![]() C.
C.![]() =
=![]() D.无法判断
D.无法判断
![]() 10. 在aL的密闭容器里,于一定温度进行2A(气)+B(气) 2C(气)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( )
10. 在aL的密闭容器里,于一定温度进行2A(气)+B(气) 2C(气)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( )
A.2molA和1molB B.1molA和1molB C.1molA和2molB D.1molB和1molC
二、选择题(每小题有1-2个选项符合题意,每小题4分,共40分)
![]() 11.可逆反应2SO2+O2 2SO3,正反应速率分别用v表示,逆反应速率用v¢表示,速率单位为mol/(L·min).当反应达到化学平衡时,正确的关系是( )
11.可逆反应2SO2+O2 2SO3,正反应速率分别用v表示,逆反应速率用v¢表示,速率单位为mol/(L·min).当反应达到化学平衡时,正确的关系是( )
A.V(SO3)=V¢(SO3) B.V(O2)=V(SO2)=V(SO3) C.V(O2)=![]() V¢(SO2) D.V¢(SO2)=V¢(SO3)=V¢(O2)
V¢(SO2) D.V¢(SO2)=V¢(SO3)=V¢(O2)
12.关于合成氨工业,下列说法正确的是( )
A.合成氨的反应是放热的,所以合成氨时温度越低,对氨的工业生产越有利。
B.根据合成氨,增大压强能提高氨的生产率,所以在合成氨工业中在条件允许的情况下应尽量增大压强。
C.生产中常使用某种廉价易得的原料适当过量,以提高另一原料的转化率。
D.使用催化剂只加快反应速度,不影响平衡移动,因此对合成氨产量无影响。
13.设NA为阿佛加德罗常数,下列叙述中正确的是( )
A 18 g D2O中含有的质子数目为10NA B 标准状况下22.4 L H2 中含中子数为2 NA
C 1molH2O2 在二氧化锰的作用下完全分解,电子转移数为2 NA
D 14g乙烯和丙烯的混合物中总原子数为3 NA个
14.下列各组物质的性质比较中,正确的是( )
A.热稳定性:PH3<SiH4<NH3<HF B.微粒直径大小:S2->Cl->Mg2+>Al3+
C.酸性强弱:盐酸>乙酸>碳酸>次氯酸
D.熔点高低:石墨>食盐>干冰>液溴
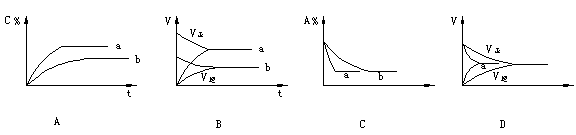
![]() 15.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( )
15.气态反应A+B C+D,其它条件不变,在有催化剂条件(a)时和无催化剂条件(b)时的反应过程中,有关的量(纵坐标)随时间(横坐标)的变化情况错误的是( )
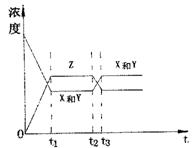 |
![]() 16.今有反应X(g)+Y(g)
2Z(g)+ △H<0若反应
16.今有反应X(g)+Y(g)
2Z(g)+ △H<0若反应
开始经t1秒后达到平衡,又经t2秒后,由于反应条件的
改变使平衡破坏,则t3时又达到平衡,如图表示,试分
析,以t2到t3秒曲线变化的原因是( )
A.增大了X和Y的浓度
B.使用了催化剂
C.增加了反就体系的压强
D.升高了反应的温度
17.下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
18.下列指定微粒的个数比为2∶1的是
( )
A Be2+离子中的质子和电子 B ![]() 原子中的中子和质子
原子中的中子和质子
C Na2CO3溶液中的阳离子和阴离子 D BaO2(过氧化钡)固体中的阴离子和阳离子
![]() 19.有关2SO2+O2 2SO3反应的下列图象正确的是( )
19.有关2SO2+O2 2SO3反应的下列图象正确的是( )
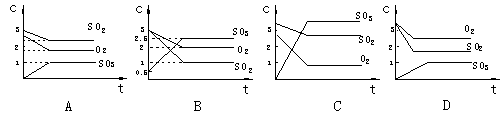 |
20.一定温度下可逆反应:A(s)+2B(g)![]() 2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g)+D(g);△H<0。现将1mol A和2molB加入甲容器中,将4 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增大
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
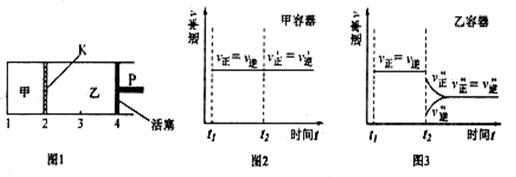 D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
 第Ⅱ卷(非选择题 共80分)
第Ⅱ卷(非选择题 共80分)
三、(本题包括3小题,共33分)
21.(13分)实验室模拟合成氨和氨催化氧化的流程如下:
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
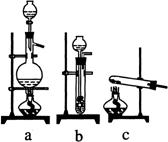
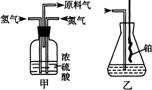 (1)从右图中选择制取气体的合适装置:氮气
、氢气
(1)从右图中选择制取气体的合适装置:氮气
、氢气
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨,
(“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式:
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
22.(12分)短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):

已知a.常见双原子单质分子中,X分子含共价键最多。b.甲分子中含10个电子,乙分子含有18个电子。
(1)X的电子式是 。
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。
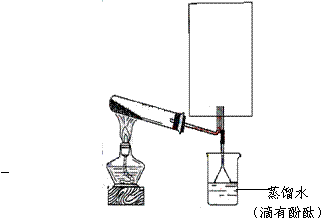 |
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中的试剂是(填写化学式) 。
③烧杯中溶液由无色变为红色,其原因是(用电离方程式表示) 。
(3)磷在Z中燃烧可生成两种产物,其中一种产物丁分子中各原子最外层不全是8电子结构,丁的化学式是 。
(4)n mol丁与n mol丙在一定条件下反应,生成4n mol乙和另一化合物,该化合物蒸气的密度是相同状况下氢气的174倍,其化学式是 。
23.(8分)下表是稀硫酸与某金属反应的实验数据:
| 实验 | 金属 | 金属 | C(H2SO4) /mol·L-1 | V(H2SO4) | 溶液温度/℃ | 金属消失 | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: 。
四、(本题包括小题,共47分)
24、(共7分)现有同温同压下等质量的二氧化硫和氧气混合,根据要求填写下列空格:
(1)分子数之比为 , (2)原子数之比为 ,(3)氧原子数之比为 ,
(4)物质的量之比为 , (5)体积之比为 ,(6)平均摩尔质量是 ,
(7)混合气体的密度对氢气的相对密度是 。
25.(10分)有四种同主族物质,它们的沸点(℃,1.01×105pa)如下表所示:
| ① | He -268.8 | Ne -249.5 | Ar (x) | Kr -151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (a) 58.7 | I2 184.0 |
| ③ | HF (y) | HCl -84.0 | HBr -67.0 | HI -35.3 |
| ④ | H2O (z) | H2S -60.2 | (b) -42.0 | H2Te -1.8 |
试根据上表回答:
⑴a为 色液体,b的分子式是:
⑵写出②系列中物质主要化学性质的递变规律(任定一种): ;
能够说明该递变规律的化学事实是(任举一例,用离子方程式表示):
。
⑶除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该
关系是:
⑷上表中,和两种物质的沸点较同系列其他物质反常,反常的主要原因是
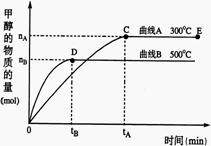 26.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
26.(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,
K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率
v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
![]() 27.(10分) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
27.(10分) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+O2(g) 2SO3(g)
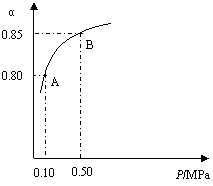 某温度下,SO2的平衡转化率(α)与体系总压强
某温度下,SO2的平衡转化率(α)与体系总压强
(P)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
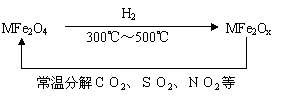 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
28.(10分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_________;XW的电子式为_______;Z元素在周期表中的位置是_______。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____;V、W的氢化物分子结合H+能力较强的是(写化学式)__ _,用一个离子方程式加以证明_____________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________________,由此可知VW和YW2还原性较强的是(写化学式)______________________。
2008届高三基本概念基本理论专题测试卷答题卷
三、(本题包括3小题,共33分)
21.(13分) (1) 、
(2) 、
(3) ,
(4) , 。
(5): (6) 、 。
22.(12分)
(1) 。
(2)①
② 。
③ 。
(3) 。(4) 。
23.(8分)
(1) , , ;
(2) ;(3) , 。
(4) 。
四、(本题包括小题,共47分)
24、(共7分)
(1) , (2) ,(3) , (4) ,
(5) , (6) ,(7) 。
25. (10分)⑴ ,
⑵ ;
。
⑶
⑷
26.(10分) (1)K= , (2) (3)
(4)
27.(10分) (1)① 。②
(2) , kJ。
(3) 。
28.(10分)
(1)______ _________; ____ ________;_________ ____。
(2) __________。(3) __________; ____________,________ _______________________________。
(4)__________________________________________, ______________________。
2008届高三基本概念基本理论专题测试卷参考答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | B | B | B | B | B | C | C | C | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | AC | BC | D | BC | AD | D | A | A | B | BD |
21. (13分)(A)(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3十5O2![]() 4NO+6H2O
4NO+6H2O
(6)NH4+
NO3-
![]() 22.(12分)(1) ②NH4Cl、Ca(OH)2 (合理答案均给分)
22.(12分)(1) ②NH4Cl、Ca(OH)2 (合理答案均给分)
 (2) ①
(2) ①
③NH3·H2O![]() NH4++OH
(3)PCl5 (4)P3N3Cl6
NH4++OH
(3)PCl5 (4)P3N3Cl6
23.(8分)(1)固体反应物的表面积 表面积越大,1和2
(2)1、3、4、6、8;2、5
(3)反应温度;6和7;8和9
(4)因为所有反应中,金属质量和硫酸溶液体积均相等,且硫酸过量,产生热量相等,所以溶液温度变化值相近
24、(7分)(1)1:2(2)3:4(3)1:2(4)1:2(5)1:2(6)42.7mol/L(7)21.35
25.(10分)(1)深红棕色(1分);H2Se(1分)
(2)氧化性逐渐减弱(2分);Cl2+2Br-= Br2+2 Cl-(2分)
(3)随着相对分子质量的增大沸点逐渐升高(2分)
(4)HF,H2O分子间易形成氢键(2分)
26.(10分)(1)K=c(CH3OH)/c(CO)·c2(H2)
减小
(2)2nB/3tBmol·(L·min)-1
(3)b c
(4)Cu2O+CO![]() 2Cu+CO2
2Cu+CO2
27.(10分)(1)①80L·mol-1 ②= (2)1.60NA ,173.4
(3)MFe2Ox+SO2→MFe2O4+S
28.(10分)⑴.N≡N;⑵.![]() ;第4周期,第VIII族
;第4周期,第VIII族
⑵.① ③;⑶.CH4;NH3
;NH3 + H3O+ ==== NH![]() + H2O
+ H2O
⑷.3SO2 + 2NO![]() + 3Ba2+
+ 2H2O ==== 3BaSO4 ↓ + 2NO + 4H+ ;SO2
+ 3Ba2+
+ 2H2O ==== 3BaSO4 ↓ + 2NO + 4H+ ;SO2