08届高三化学学科练习试题
试卷满分:150分 考试时间:120分钟
| 题号 | 一 | 二 | 三 | 四 | 五 | 六 | 七 | 总分 |
| 得分 |
第I卷(共66分)
相对原子质量:C—12 H—1 O—16 N—14 Mg—24 Cu—64 Al—27 Li—7
一.选择题(本题共10分):每小题2分,每题只有一个正确选项
1.为维持人体内电解质平衡,人在大量出汗后应及时补充的离子是 ( )
A、Mg2+ B、Ca2+ C、Na+ D、Fe3+
2.下列说法中错误的是 ( )
A、磺化、硝化、水化、风化、钝化等都是化学变化
B、干馏、常压分馏、减压分馏都是物理变化
C、甘油不是油,纯碱不是碱,酚醛树脂不是酯,干冰不是冰
D、水煤气、裂解气、焦炉气、天然气都是混合物
3.为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
( )
A、硅胶、硫酸亚铁 B、无水硫酸铜、蔗糖 C、食盐、硫酸亚铁 D、生石灰、食盐
4.最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如下图所示,已知断裂1moIN-N吸收167kJ热量,生成1molN≡N放出942kJ热量,根据以上信息和数据,下列说法正确的是 ( )
![]() A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
A.N4属于一种新型的化合物 B.N4与N2互为同素异形体
C.N4沸点比P4(白磷)高 D.1mo1N4气体转变为N2将吸收882kJ热量
![]()
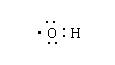 5.下列化学用语表示错误的是
( )
5.下列化学用语表示错误的是
( )
A.羟基电子式 B.镁离子结构示意图
![]()
![]() C.次氯酸电子式 D.氨分子结构示意图
C.次氯酸电子式 D.氨分子结构示意图
二.选择题(本题共36分):每小题3分,每题只有一个正确选项
6.已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如下图所示,下列说法正确的是 ( )
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
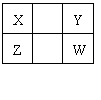 C.W的气态氢化物的稳定性一定比Y的强
C.W的气态氢化物的稳定性一定比Y的强
D.Z的最高价氧化物的水化物的酸性一定比W的强
7.“魔棒”常被用于晚会现场气氛的渲染。其发光原理是利用H2O2氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
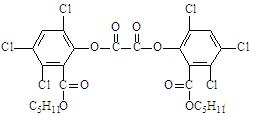
下列有关说法正确的是 ( )
A.草酸二酯属于芳香烃 B.草酸二酯的分子式为C26H23O8Cl6
C.草酸二酯难溶于水 D.1mol草酸二酯最多可与4molNaOH反应
8.长征2号火箭承担运载“神六”的使命,氢化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是 ( )
A、LiH、LiD、LiT的摩尔质量之比为1:2:3 B、它们都是强氧化剂
C、H、D、T之间互称为同素异形体 D、它们都是强还原剂
9.美国天文学家在亚利桑那州一天文观察台探测到了银河系中心2.6万光年处一巨大气云中的特殊电磁波,这种电磁波表明那里可能有乙醇醛糖分子存在。下列有关乙醇醛糖(HOCH2CHO)的有关说法不正确的是 ( )
A.乙醇醛糖是一种有机物,易溶于水
B.乙醇醛糖能发生取代反应、消去反应、氧化反应以及还原反应
C.乙醇醛糖与甲酸甲酯互为同分异构体
D.1 mol 乙醇醛糖与足量的银氨溶液作用,可析出2molAg
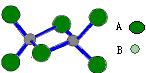 10.如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是 ( )
10.如图是某无机化合物的二聚分子,该分子中A、B两种元素都是第三周期的元素,分子中所有原子的最外层电子都达到8个电子的稳定结构。下列说法不正确的是 ( )
A.该化合物的化学式是Al2Cl6
B.该化合物是离子化合物,在熔融状态下能导电
C.该化合物在固态时所形成的晶体是分子晶体
D.该化合物中不存在离子键,也不含有非极性共价键
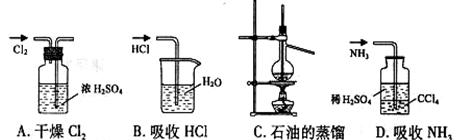
11.用下列实验装置完成对应的实验(部分仪器巳省略),能达到实验目的的是 ( )
12.设NA为阿佛加德罗常数,下列说法不正确的是 ( )
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
 C.46g二氧化氮和46g四氧化二氮含有的原子数均为3 NA
C.46g二氧化氮和46g四氧化二氮含有的原子数均为3 NA
D.在1L2mol/L的硝酸镁溶液中含有的硝酸根离子数为4 NA
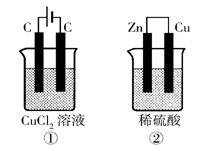
13.如右图所示的两个实验装置中,溶液的体积均为200mL,开
始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得
导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的
变化,则下列叙述中正确的是 ( )
A.产生气体的体积:①>②
B.溶液的pH变化:①增大,②不变
C.电极上析出物质的质量:①>②
D.电极反应式:①中阳极 2Cl--2e-
Cl2 ↑
②中负极 2H++2e- H2↑
14.已知,同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,则以下离子方程式错误的是 ( )
A.Mg2+ + 2 HCO3- + 2Ca2+ + 4 OH- = Mg(OH)2↓ + 2CaCO3↓ + 2H2O
B.Cu2+ + H2S = CuS↓ + 2H+
C.Zn2+ + S2- + 2H2O = Zn(OH) 2↓ + H2S↑
D.FeS + 2H+ = Fe2+ + H2S↑
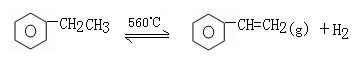 15.工业生产苯乙烯是利用乙苯的脱氢反应:
15.工业生产苯乙烯是利用乙苯的脱氢反应:
(g) (g) +Q
针对上述反应,在其它条件不变时,下列说法正确的是 ( )
A.加入适当催化剂,可以提高乙苯的转化率
B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C.在加入乙苯至达到平衡过程中,混合气体的平均相对分子质量在不断增大
D.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
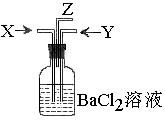 16.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
16.碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是
( )
A.在Z导管口有红棕色气体出现
B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是亚硫酸钡
D.洗气瓶中产生的沉淀是碳酸钡
17.在含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.01mol的溶液中加入0.01mol铁粉,充分搅拌后发生的变化是 ( )
A.铁溶解,但没有其它金属析出 B.铁溶解,只析出0.01mol银
C.铁溶解,析出0.01mol银和0.005mol铜 D.铁溶解,只析出0.01mol铜
三.选择题(本题共20分):每小题4分,每小题有一个或两个正确选项。只有一个正确选项的,多选不给分;有两个正确选项的,选对一个给2分,选错一个该小题不给分
18.三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:
C3N3(OH)3
![]() 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2 ![]() 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是 ( )
A.C3N3(OH)3与HNCO为同一物质 B.HNCO是一种很强的氧化剂
C.1 molNO2在反应中转移的电子为4mol D.反应中NO2是还原剂
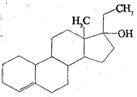 19.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置
19.为实现2008北京“科技奥运”战略,我国兴奋剂检测生物芯片装置
已定型和批量生产,可快捷检测常见的16种兴奋剂。已知某兴奋剂乙
基雌烯醇(etylestrenol)的结构如右图所示。下列叙述中正确的是( )
A、该物质可以视为酚类
B、在浓硫酸作用下,分子内消去一个水分子,产物有二种同分异构体
C、能使溴的四氯化碳溶液褪色
D、该物质分子中的所有碳原子均共面
20.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+) >c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
21.常温下把盐酸和氨水等体积混合后,其溶液的PH值恰好等于7,则下列说法正确的是 ( )
A.盐酸中C(H+)一定大于氨水中C(OH-)
B.盐酸的物质的量浓度一定小于氨水的物质的量浓度
C.反应后生成的盐溶液没有发生水解
D.盐酸中氯化氢的物质的量等于氨水中氨的物质的量
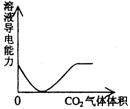
22.下列实验过程中产生的现象与对应的图形不相符合的是 ( )
A.NaHSO3粉末加入HNO3溶液中 B.H2S气体通入氯水中
![]()
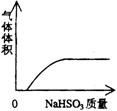
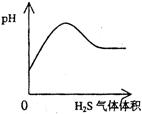
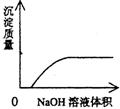 C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
C.NaOH溶液滴入Ba(HCO3)2溶液中 D.CO2气体通入澄清石灰水中
 |
第II卷(本卷共84分)
四.(本题共24分)
23.下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
|
| ||||||
|
|
|
| |||||
|
|
|
|
(1)上述元素的单质中熔点最高的可能是 _____(填字母)。
(2)在一定条件下,![]() 与
与![]() 可形成一种极易溶于水的气态化合物,其电子式为
;
可形成一种极易溶于水的气态化合物,其电子式为
;
(3)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_________族元素。
(4)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的_______(填字母)元素组成的,飞船中需要制造一种适合航天员生存的人工生态环境,还应该在氧气中充入一种稀释气体,该气体分子式为________。在运送飞船的火箭推进器中盛有分别由ae和af元素组成的两种液态化合物,它们的分子皆为18电子微粒,当它们混合反应时即产生e的单质和a2f。请写出该反应的化学方程式为____________________________。这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是______________________________________________。
24.在上海召开的第7届全球人类基因组大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期性幼粒白血病。已知砒霜具有两性。
(1)完成并配平下列化学反应方程式:
___ As2O3 + ___ Zn + ___ H2SO4 →___ AsH3 +___ ZnSO4 + ___ ___________
(2)As2O3在上述反应中显示出来的性质是___________,H2SO4显示出来的性质是_____________(均填写编号)
①氧化性 ②还原性 ③酸性 ④碱性
(3)AsH3又称为胂。生产0.1mol胂,则转移电子的物质的量为__________mol
(4)砷原子最外层电子排布式为___________。在AsH3、PH3 、H2S三种物质中,最不稳定的是____________________
(5)砒霜在烧碱溶液中反应的离子方程式为________________________________
25.500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生
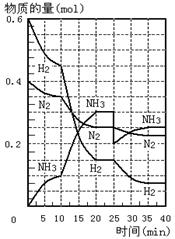 反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完
反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完
成下列各题:
( 1 ) 反应达到平衡时,平衡常数表达式 K=___________________
此时增加N2的量,平衡常数将______________(填“增大”“减小” 或 “不变”)
( 2 ) 500℃、20 MPa时,反应处于平衡状态的时间___________
___________________________ 。
( 3 ) 反应开始到第一次平衡时,N2的平均反应速率为________________。
( 4 ) 据图判断,反应进行到10 min至20 min时曲线发生变化的原因是:____
__________________反应进行至25min时,曲线发生变化的原因是_____________________________________________
五.(本题共24分)
26.某化学课外兴趣小组探究铜跟浓硫酸的反应情况:
取6.4g铜片和10ml 18mol/L浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时他们根据所学的化学知识认为还有较多的硫酸剩余。
(1)请写出铜跟浓硫酸反应的化学方程式:____________________________________________。试问:为什么较多的余酸不与铜继续反应?简述理由:_________________________________________
(2)可以证明有余酸的实验方案一是___________。(填写字母编号,多选扣分)
A、再加入足量镁粉 B、再滴入BaCl2溶液 C、再加入银粉 D、再滴入Na2CO3溶液
在上述可证明存在余酸的实验方案中,继续通过测定生成气体的量即可确定余酸的浓度,测定方法有多种,方法①_____________________________②___________________________________
(3)可以证明有余酸的实验方案二是:测定反应后混合溶液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤出沉淀,洗涤,干燥,称量为A克。
写出生成沉淀的离子反应方程式:_____________________________。如果在反应后的溶液中直接加入足量Na2S溶液,充分反应后,,过滤出沉淀,洗涤,干燥,称量为B克,则B可能_________A(填写“大于”“小于”或“等于”),用化学方程式说明原因____________________________________。
(4)上述实验方案中,能够计算余酸浓度的数据除测算产生气体的物质的量或反应掉铜的物质的量外,尚缺少的测量数据是_________________________________________________
27.在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。


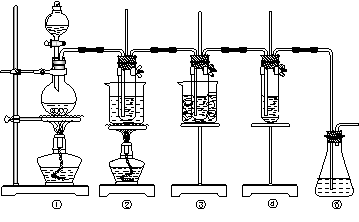

图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有________或_________(填写化学试剂名称)的净化装置。
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:______________________________________。
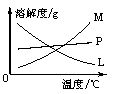
②的试管中反应的离子方程式为___________________________。反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
(4)有同学指出该实验装置存在明显不妥之处,请在原实验装置图上作图完善,说明使用何种化学试剂,理由__________________________________________________________
六.(本题共20分)
28.近日,油炸薯条再次出现食品安全危机,因为其中反式脂肪酸(trans fatty acids简称TFA)的含量增加了1/3。中国食疗网发布“反式脂肪酸预警报告”,报告称:摄入过多的反式脂肪酸,容易堵塞血管而导致心脑血管疾病。顺式脂肪酸、反式脂肪酸的结构如图所示。
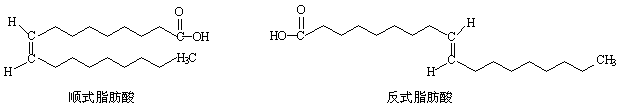
试回答下列问题:
(1)顺(反)式脂肪酸中所含官能团名称是 。
(2)与上述顺(反)式脂肪酸互为同系物的最简单物质的结构简式为_____________。
(3)上述顺式脂肪酸和反式脂肪酸都能与H2在一定条件下发生氢化反应,其产物关系为 。
A.同分异构体 B.同系物 C.同一种物质 D.同素异形体
(4)研究表明,在特定的条件下,顺式脂肪酸与反式脂肪酸会产生互变,油脂长时间高温加热及油脂催化加氢都会使反式脂肪酸的含量增高。亚油酸(9,12-十八碳二烯酸)与氢气以1∶1催化加氢过程中,考虑顺、反异构,生成的脂肪酸最多有 种。
(5)据专家介绍,多食用花生油对人体有益,是因为花生油中含反式脂肪酸较少,且含有对人体有益的白藜芦醇(化学名称为芪三酚),其结构简式为: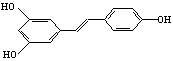
试写出1mol白藜芦醇与足量溴水发生反应的化学方程式: 。
29.克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
 |
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以在一定条件下与氢气发生加成反应生成
 |
,其反应方程式为 (不要求标出反应条件)
(2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 (填字母)
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠反应生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 (不要求标出反应条件)
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 。
七.(本题共16分)
30.目前一种新型抗酸剂能迅速改善和缓解胃酸过多的症状,它主要由碳酸镁、氢氧化镁和氢氧化铝组成。现按如下步骤测定药剂中三种主要成分的配比:
⑴取药剂样品,研磨后,加入50mL3.6 mol·L—1盐酸,正好完全反应并收集得到标准状况下224mL气体
⑵过滤,弃去其中不溶性物质(其余成分不参与反应)
⑶取⑵中滤液,加入足量的NaOH溶液后,过滤、洗涤、灼烧,所得固体2.4g。
试求该药剂中三种主要成分的物质的量之比。
31、某污水处理厂用化学和生物方法处理污水,若污水中所含糖类((CH2O)n)有45%被完全氧化,即发生反应(CH2O)n + nO2 → nCO2 + nH2O;另有10%经过发酵过程进行无氧分解,即2(CH2O)n→ nCO2 + nCH4。其余部分糖类仍然留在沉积物中。当该厂每天生产CO2和CH4共16.0m3(标准状况)时,求
(1)每天被氧化和被发酵的糖类共多少千克?
(2)每天有多少千克糖类留在沉积物中?
(3)污水中的糖类通过完全氧化、无氧发酵和沉积下来得以处理,使水体得以消除糖类引起的污染。若污水中糖类含量为250mg·m-3,该工厂每天可处理多少立方米污水?
(4)生成的CH4可用来生产水煤气:CH4 + H2O![]() CO+ 3H2,该厂每天能生产多少立方米水煤气(标准状况)?
CO+ 3H2,该厂每天能生产多少立方米水煤气(标准状况)?