08届高三化学总复习实验专题阶段测试
第Ⅰ卷 选择题(共70分)
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个正确选项)
1.下列仪器①普通漏斗 ②容量瓶 ③蒸馏烧瓶 ④坩埚 ⑤分液漏斗 ⑥滴定管
⑦燃烧匙 ⑧烧杯 常用于物质分离的是
A. ①③④⑤ B. ②④⑥⑧ C. ①③⑤ D. ③⑤⑦
2.下列保存物质的方法正确的是
A.氢氟酸保存在使用塑料盖的玻璃瓶中 B.氯水应保存在棕色的细口瓶中
C.NaOH固体可长期保存在玻璃瓶中 D.金属锂应保存在煤油中防止被氧化
3.按下列实验方法制备气体,合理又实用的是
A.锌粒与稀硝酸反应制备氢气 B.向饱和氯化钠溶液中滴加浓硫酸制备HCl
C.亚硫酸钠与浓硫酸反应制备SO2 D.大理石与浓硫酸反应制备CO2
4.下列实验能达到测量要求的是
A. 用托盘天平称取35.20g NaCl B. 用10mL量筒量取8.50mL盐酸
C. 用25ml滴定管量取15.80ml溶液 D. 用pH试纸测得溶液pH值为4.2
5.过氧化氢(H2O2)的沸点比水高,但受热易分解。某试剂厂先制得7% ~ 8%的过氧化氢溶液再浓缩成30%的溶液,可采用的适宜方法是
A.减压蒸馏 B.常压蒸馏
C.加压蒸馏 D.加生石灰后常压蒸馏
6.下列分离或提纯物质的方法错误的是
A.用渗析的方法精制氢氧化铁胶体
B.用溶解、过滤的方法提纯含有少量碳酸钙的碳酸钡
C.用加热的方法提纯含有少量氯化铵的氯化钠固体
D.用蒸馏的方法分离、提纯苯和硝基苯
7.下列有关实验问题的处理方法正确的是
A.浓硫酸不慎溅到皮肤上,应立即用碳酸钠溶液冲洗
B.制备气体时为防止气流不通畅,应检查乳胶管是否弯折堵塞
C.燃着的酒精灯打翻在桌面上引起失火,可用水浇灭
D.铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体
8.有三组物质:①NO2和溴蒸气; ②乙醛、苯、硝基苯三种无色液体; ③CaC2、CuSO4(无水)、CaCO3、Na2SO4、干燥的碱石灰(加有少量酚酞)五种固体,只要有水就能区别开的是
A、① B、①③ C、②③ D、①②③
9.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在1~100 nm之间 B.都能透过半透膜
C.加热蒸干、灼烧后都有氧化铁生成 D.都呈红褐色
10.水泥和冶金工业所产生的废气中含有大量的烟尘,其中大部分烟尘微粒直径在1~100 nm之间。工业上采用将废气通过连有高压电的铁丝的方法净化之。这种做法所应用的原
理是
A.电泳 B.电解 C.凝聚 D.布朗运动
二、选择题(本题包括10小题,每小题4分共40分。每小题有1~2个正确选项。若正确答案只包含一个选项,多选时该题为 0 分;若正确答案包括两个选项,只选一个且正确给2分,选两个且都正确给4分,但只要选错一个,该小题为 0分)
11.下列有关化学实验的操作或说法中,正确的是
A.用有少量蒸馏水的锥形瓶装待测液进行中和滴定实验,对测定结果没有影响
B.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次
C.苯酚中滴加少量稀溴水出现三溴苯酚白色沉淀
D.检验溴乙烷中的溴元素时,将溴乙烷和氢氧化钠溶液混合加热后,需加硫酸酸化
12.“厨房化学”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探究的活动。下列实验在厨房中不能完成的是
A.检验自来水中含有Cl—离子 B.检验鸡蛋壳中含有碳酸盐
C.检验加碘食盐中不含碘单质 D.检验蛋白质在加热条件下能发生变性
13.某同学设计实验证明NaOH溶液能使酚酞试液变红是OH-的性质,其中没有意义的是
A.取KOH、Ba(OH)2、Ca(OH)2溶液分别与酚酞试液作用,观察溶液颜色
B.取NaOH、NaCl、HCl溶液分别与酚酞试液作用,观察溶液颜色
C.向滴有酚酞的20.00mL 0.10mol·L-1 NaOH溶液中,逐滴加25.0mL0.10mol·L-1 盐酸,观察溶液颜色的变化
D.向滴有酚酞的25.0mL 0.10mol·L-1NaOH溶液中,逐滴加20.00mL 0.10mol·L-1盐酸,观察溶液颜色的变化
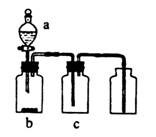 14.用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
14.用下图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 钢片 | 氢氧化钠溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性高锰酸钾溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀盐酸 | CaCO3粉末 | 浓硫酸 |
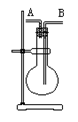 15.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、⑦NO2、⑧SO2,下列操作正确的是
15.某学生想利用下图装置(烧瓶位置不能移动)收集下列气体:①H2、②Cl2、③CH4、④HCl、⑤NH3、⑥NO、⑦NO2、⑧SO2,下列操作正确的是
A.烧瓶是干燥的,由A进气收集①③⑤
B.烧瓶是干燥的,由B进气收集②④⑥⑦⑧
C.在烧瓶中充满水,由A进气收集①③⑤⑦
D.在烧瓶中充满水,由B进气收集⑥
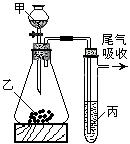
16.用下图所示装置进行实验,下列所得结论正确的是
| 甲 | 乙 | 丙 | 结论 | |
| A. | 盐酸 | 石灰石 | 苯酚钠溶液 | 酸性: HCl > H2CO3 > 苯酚 |
| B. | 盐酸 | 硫化亚铁 | 溴水 | 还原性: S2— < Br— < Cl— |
| C. | 浓 盐酸 | 高锰酸钾 | 溴化钾溶液 | 氧化性: KMnO4 > Cl2 > Br2 |
| D. | 水 | 电石 | 溴水 | 稳定性: 水 > C2H2 > Br2 |
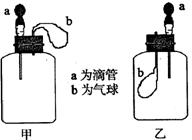 17. 如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是
17. 如图所示:挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球影响,以及外界和广口瓶间热量的传递影响)。则所用试剂不可能是
A.甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体)
B.甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气
C.甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液
D.甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2
18.下列实验操作会导致实验结果偏高的是
A.配制0.1mol·L-1NaCl溶液时,定容时俯视刻度线
B.测定中和热实验中,用18.4mol·L-1硫酸溶液代替0.5mol·L-1硫酸溶液
C.测定硫酸铜晶体结晶水含量的实验中,加热分解后的样品置于空气中自然冷却
D.用NaOH标准液测定未知浓度的盐酸时,滴定后滴定管尖嘴部分存在一段空气
19.下列实验设计能够成功的是
| 实验目的 | 实 验 步 骤 及 现 象 | |
| A | 检验亚硫酸钠试样是否变质 |
|
| B | 检验某盐是否为铵盐 |
|
| C | 证明酸性条件H2O2氧化性比I2强 |
|
| D | 除去氯化钠晶体中少量硝酸钾 |
|
| 20℃ | 50℃ | |
| A的溶解度 | 35.7g | 46.4g |
| B的溶解度 | 31.6g | 108g |
20.现有两种不含结晶水的盐,它们在不同温度下的
溶解度见右表,下列说法中,正确的是
A.可采用重结晶法使A、B混合物分离
B.向各有50mL水的烧杯中分别加入16g A和
16g B,只能得到B的饱和溶液
C.在20℃时,A、B都可以配成溶质质量分数为25%的不饱和溶液
D.若把208g B的饱和溶液降温到20℃,析出的B是76.4g
第Ⅱ卷 非选择题(共80分)
三、填空题(本题包括4小题,每空2分,共40分)
21.(10分)⑴(6分)在中学化学实验中可用于分离或提纯的方法很多,如蒸馏、结晶、过滤、盐析……,下列各组混合物的分离或提纯应选用什么方法最合适,若需多步操作,请按顺序填写。
①除去AgI胶体中混有的I—离子_____________________;
②除去苯中含有的少量苯酚____________________________;
③分离CuSO4·5H2O和BaSO4的混合物 。
⑵(4分)下列有关化学实验的操作或说法中,正确的是(填字母代号) 。
A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到
混合物变稠,即可得到肥皂
B.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的
最高温度
C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清
液于试管中,滴加KSCN溶液2滴~3滴即可
D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热
蒸发滤液即可得硫酸亚铁晶体
E.进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱
脂棉变成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加
热至沸腾即可
22、(10分)有一瓶澄清的溶液,其中可能含有NH4+ 、K+ 、Na+ 、Mg2+ 、Ba2+ 、Al3+ 、Fe3+ 、Cl-、I-、 NO3-、CO32- 、S2- 、SO42- 、AlO2-、SO32-、MnO4-, 取该溶液进行以下实验:
⑴取pH试纸检验,溶液呈强酸性,可以排除 离子的存在。
⑵取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排除 离子的存在。
⑶另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除 离子的存在。
⑷取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成。
⑸将⑶得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定:该溶液中肯定存在的离子是 ,
还不能确定是否存在的离子是 。
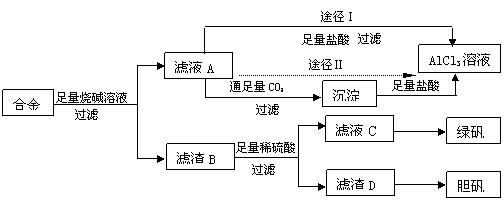 |
23.(10分)某化学兴趣小组用含有铝、铁、铜的合金工业废料制取纯净的氯化铝溶液、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O),拟用如下实验方案:
试回答下列问题:
(1)实验中多次进行过滤操作,过滤所用的玻璃仪器有 。
(2)从滤液C中得到绿矾晶体的实验操作是 ___________。
(3)H2O2是一种绿色氧化剂,应用十分广泛,在滤渣D中加入稀硫酸和H2O2来制备胆矾晶体是一种绿色工艺,该反应的总化学方程式为 ____________ ______ 。
(4)由滤液A得AlCl3溶液的途径有Ⅰ和Ⅱ,你认为合理的是途径 (填“Ⅰ”或“Ⅱ”),理由是 。
24.(10分)现有中学常见的三种单质甲、乙、丙,它们在一定条件下能发生如下变化,其中次要生成物已略去。
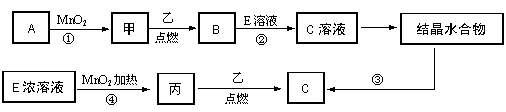
(1)已知乙元素的+2价离子与Ne原子具有相同的电子层结构,则④的离子方程式
为 。
(2)若反应①可在常温下进行,则A的名称是___________,若反应①需在加热条件下进
行,则反应的化学方程式为 。
(3)从C溶液中得到C需经过两步操作:先从C溶液中得到晶体,再将得到的晶体转化
为C。从C溶液中得到晶体的过程被称为______________,将得到的晶体转化为C的实验条件是________________________________________。
四、填空题(本题包括2小题,共40分)
25.(07上海;18分)以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。
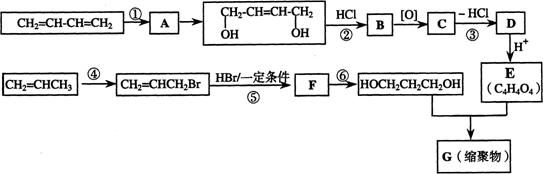
请完成下列各题:
(1)写出反应类型:反应① ;反应④ 。
(2)写出反应条件:反应③ ;反应⑥ 。
(3)反应②③的目的是: 。
(4)写出反应⑤的化学方程式: 。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是 (写出一种物质的结构简式),检验该物质存在的试剂是 。
(6)写出G的结构简式 。
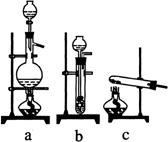 26.(07上海;22分) 实验室模拟合成氨和氨催化氧化的流程如下:
26.(07上海;22分) 实验室模拟合成氨和氨催化氧化的流程如下:
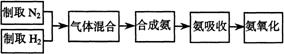
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从右图中选择制取气体的合适装置:
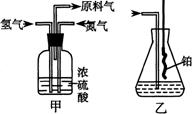 氮气
、氢气
。
氮气
、氢气
。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有 、 。
(3)氨合成器出来经冷却的气体连续通人乙装置的水中吸收氨, (“会”或“不会”)发生倒吸,原因是: 。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是: ,锥形瓶中还可观察到的现象是: 。
(5)写出乙装置中氨氧化的化学方程式: 。
(6)反应结束后锥形瓶内的溶液中含有H+、OH-、 、 离子。
08届高三化学总复习实验专题阶段测试
答题卷(考试完毕后只交答题卷)
注意:所有答案必须写在答题卷上相应的位置,否则计0分。
记分栏(学生不得填写)
| 题号 | 一 | 二 | 三 | 四 | 总 分 |
| 得分 |
![]()
 一.选择题(单项选择,每小题3分共30分)
一.选择题(单项选择,每小题3分共30分)
| 题号 | 1 | 2 | 3 | 4 | 5 |
| 答案 |
|
|
|
|
|
| 题号 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
二.选择题(每小题有一个或两个选项符合题意,每小题4分,共40分)
| 题号 | 11 | 12 | 13 | 14 | 15 |
| 答案 |
|
|
|
|
|
| 题号 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
|
|
|
|
|
三、实验题(本题共4小题,每空2分,共40分)
21.(本题共10分)
(1)(6分)①________ ;
②____________________________________ ;
③_____________ 。
(2)(4分) _____________ ;
22.(本题共2×5=10分)
(1)________ 。
(2)________ 。
(3) 。
(5)_____________ , 。
23.(本题共2×5=10分)
(1) 。
(2) 。
(3) 。
(4)_________ ,理由是
。
24.(本题共2×5=10分)
(1) 。
(2) , 。
(3) , 。
四.填空题(本题共2小题,每空2分,共40分)
25.(本题共2×9=18分)
(1) ; 。
(2) ; 。
(3) 。
(4) 。
(5) , 。
(6) 。
26.(本题共2×11=22分)
(1) 、 。
(2) 、 。
(3) ,原因是:
。
(4)原因是: ,
现象是: 。
(5) 。
(6) 、 。
参考答案
一、选择题(本题共10小题,每小题3分,共30分。每小题只有一个正确选项)
1. C 2.B 3.C
4.C 5.A 6.B
7.B 8.D 9.C
10.A
二、选择题(本题包括10小题,每小题4分共40分。每小题有1~2个正确选项。)
11.AB 12.A 13.D 14.D 15.A 16.AC 17.C 18.AB 19.D 20.A
三、填空题(本题包括4小题,每空2分,共40分)
21.(10分)⑴(每空2分,共6分)渗析 加入NaOH溶液、分液 溶解、过滤、结晶
⑵(选对1个得2分,错选1个计0分,全对得4分)BC
22、(10分,每空2分,每空只有全对才得分,否则不得分)
(1). CO32 -、S2- 、AlO2- 、SO32-
(2). Fe3+、NO3-、MnO4- (3) . Mg2+、Al3+
(5) .I- 、NH4+ 、Ba2+ ; K+ 、Na+、Cl-
23.(10分)
(1)烧杯、漏斗、玻璃棒 (2)蒸发浓缩、冷却结晶
(3) Cu+H2O2+H2SO4+3H2O=CuSO4·5H2O或Cu+H2O2+H2SO4=CuSO4+2H2O
(4)途径Ⅱ 因为滤液A是NaAlO2和NaOH溶液,按途径Ⅰ直接向A中加入盐酸得到的AlCl3溶液中含有大量的NaCl杂质;按途径Ⅱ通入CO2气体,得Al(OH)3沉淀,将Al(OH)3溶解于盐酸中得到的是纯净的AlCl3溶液(每空2分)
24.(10分)(1)MnO2+4H++2Cl-====Mn2++Cl2↑+2H2O
|
(2)双氧水或过氧化氢;2KClO3====2KCl+3O2↑
(3)结晶;在HCl气流中加热(只答加热不得分)(每空2分)
四、填空题(本题包括2小题,共40分)
25.(每空2分,共18分)
[1].(1)加成反应 取代反应 (2)NaOH/醇溶液(或KOH醇溶液) NaOH/水溶液
(3)防止双键被氧化 (4)CH2=CHCH2Br+HBr→CH2Br-CH2-CH2Br
(5)HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH 新制氢氧化铜悬浊液
(6)![]()
26.(每空2分,共22分)
(1)a、b
(2)干燥气体 控制氢气和氮气的流速
(3)不会 因为混合气体中含有大量难溶于水的氮、氢两种气体
(4)说明氨的氧化反应是一个放热反应 有红棕色气体产生
(5)4NH3十5O2![]() 4NO+6H2O
(6)NH4+
NO3-
4NO+6H2O
(6)NH4+
NO3-