08届高三化学上学期第7次测试试题
考查范围:基本理论之电化学 元素化合物之金属元素
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Fe 56 Cu 64 Cl 35.5
Ba 137 Al 27 Ca 40 Fe 56 I 127
说明:本试卷分选择题和非选择题两部分,满分为150分。考试用时120分钟。
第I卷(选择题,共70分)
一、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.氯碱工业电解饱和食盐水时,阳极的电极反应式为:2Cl- -2e-= Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- = 4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- = Cu2+
D.钢铁发生电化腐蚀的正极反应式:Fe -2e- = Fe2+
2. V mL Al2(SO4)3溶液中含有a gSO42-,若把此溶液取一半加水稀释至2V mL,则稀释后溶液中Al3+的物质的量浓度为
A.125a/(36V) mol/L B.125a/(72V) mol/L
C.250a/(36V) mol/L D.a/(576V) mol/L
3.将铜放入稀硫酸中,加热无明显反应发生。但加入某盐后,发现铜粉的质量逐渐减少,该盐可能是
A.氯化铝 B.硫酸锌 C.硝酸钾 D.氯化钠
4.下列化合物不能通过化合反应获得的是
A.CuS B.Na2O2 C.Fe(OH)3 D.FeS
5.若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能大量共存的是
A. Fe3+、NO3-、Cl-、Na+ B.Ba2+、Mg2+、HCO3-、AlO2-
C.NO3-、Na+、K+、CO32- D.NO3-、K+、AlO2-、OH-
6.某学生设计了如图的方法对A盐进行鉴定:
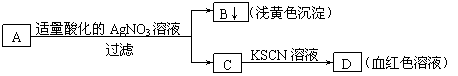 |
| |
由此分析,下列结论中,正确的是
A.A中一定有Fe3+ B.C中一定有Fe3+
C.B为AgI沉淀 D.A一定为FeBr2溶液
7.化学实验室中常将溶液或试剂进行酸化,下列酸化处理中正确的是
A.鉴别溶液中是否含有Br—时,所加的AgNO3溶液用硝酸酸化
B.检验C2H5Cl中含Cl元素时,将C2H5Cl和NaOH溶液混合加热后,加硫酸酸化
C.鉴定待测溶液中是否含有SO32—时,用硝酸酸化
D.为提高KMnO4溶液的氧化能力,用盐酸将KMnO4溶液酸化
8.向一定量的Cu、Fe2O3的混合物中加入300mL 1mol/L的HCl 溶液,恰好使混合物完全溶解,所得溶液中加入KSCN溶液后无红色出现,若用过量的CO在高温下还原相同质量的此混合物,固体的质量减少了
A. 6.4g B. 4.8g C. 2.4g D. 1.6g
9.下列各组物质的溶液,前一种溶液逐滴滴入后一种溶液中,与后一种溶液逐滴滴入前一种溶液中产生的现象相同的是
①Ba(OH)2和稀H3PO4 ②HNO3和NaAlO2 ③NaOH和AlCl3 ④Ca(HCO3)2和Ba(OH)2 ⑤Na2CO3和HCl ⑥AgNO3和NH3·H2O ⑦NaHCO3和HCl
A.①⑤ B.②④ C.⑤⑦ D.④⑦
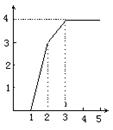 10.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
10.某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标/mol·L-1)和加入铁粉的物质的量(横坐标/mol)之间的关系如图所示。则溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为:
![]() A.1∶1∶1
A.1∶1∶1
B.1∶3∶1
C.3∶3∶8
D.1∶1∶4
二、选择题(本题包括10小题,每小题4分,共40分。每小题只有一个或两个选项符合题意。若正确答案包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
11.“拟晶”(quasicrystal)是一种具有凸多面体规则外形但不同于晶体的固态物质。A165Cu23Fel2是二十世纪发现的几百种拟晶之一,具有合金的某些优良物理性能。有关这种拟晶的说法错误的是
A.A165Cu23Fel2的硬度比金属A1、Cu、Fe都大
B.A165Cu23Fel2中三种金属的化合价均可视作零;
C.A165Cu23Fel2不可用作长期浸泡在海水中的材料
D.1mol A165Cu23Fel2溶于过量的稀硝酸时共失去265 mol电子
12.事实上,许多非金属氧化物在一定条件下能与Na2O2反应,且反应极有规律。如:Na2O2+SO2 = Na2SO4、Na2O2+SO3 = Na2SO4+ O2,据此,你认为下列方程式中不正确的是
A.2Na2O2+2Mn2O7=4NaMnO4+O2↑ B.2Na2O2+P2O3=Na4P2O7
C.2Na2O2+2 N2O3=4NaNO2+O2↑ D.2 Na2O2+2 N2O5 =4NaNO3+O2↑
13.向1.00 L 0.3 mol/L的NaOH溶液中缓慢通入CO2气体至溶液增重8.8g,所得溶液中,下列说法正确的是
A.溶质为Na2CO3
B.溶质为Na2CO3、NaHCO3
C.![]() c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H +)
14.500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
15.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入少量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O
C.碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O
D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
16.已知:(1)Zn(s)+1/2O2(g)= ZnO(s) ΔH= —348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)= Ag2O(s) ΔH= —31.0kJ/mol,则Zn(s)+ Ag2O(s)= ZnO(s)+ 2Ag(s)的ΔH等于
A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.317.3 kJ/mol
17.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6![]() CoO2+LiC6,下列说法正确的是
CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为LiC6-e- = Li++C6
B.放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
18.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以KOH为电解质,电池总反应式为: Zn+2MnO2+2H2O= 2MnOOH+Zn(OH)2。下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:MnO2+H2O+e—= MnOOH+OH—
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.锌锰碱性电池是二次电池,所以性能比普通锌锰电池好
19.已知反应![]() 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是
A.![]() 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
B.![]() 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
C.![]() 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液
D.![]() 水溶液的导电性强,因此
水溶液的导电性强,因此![]() 一定是离子化合物
一定是离子化合物
20.MnO2和Zn是制造干电池的重要原料,工业上用软锰矿和闪锌矿联合生产MnO2和Zn的基本步骤为:
⑴ 软锰矿、闪锌矿与硫酸共热: MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S+2H2O。
![]() ⑵ 除去反应混合物中的不溶物
⑵ 除去反应混合物中的不溶物
⑶ 电解混合液MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4
下列说法不正确的是
A.步骤⑴中MnO2和H2SO4都是氧化剂
B.步骤⑴中每析出12.8g S沉淀共转移0.8mol电子
C.电解时MnO2在阳极处产生
D.硫酸在生产中可循环使用
第II卷(非选择题,共80分)
21.(10分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e→NO+2H2O
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式
(2)反应中硝酸体现了 、 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是 mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
。
22.(10分)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 。写出H2O2在二氧化锰作用下发生反应的化学方程式 。
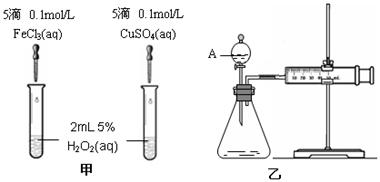 |
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,(1分)检查该装置气密性的方法是
,实验中需要测量的数据是 。(1分)
23.(12分)某无色透明溶液可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-等,取该溶液进行如下实验:
①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
⑴在实验①中,下图所示的操作中正确的是___________(填代号)
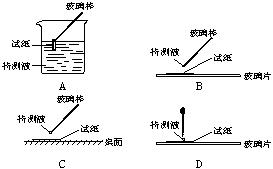
⑵根据上述实验判断原溶液中肯定存在的离子是______________,肯定不存在的离子是_____________
⑶写出与②③④三个实验有关的离子方程式:
②: ___ ___________ _____ _______ ;③: _ ______ ________________ ;
④: ___ ______ ___________ _____
24.(14分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为[Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应: ;
化合反应: 。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
25.(11分)6、已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,反应②为D的浓溶液与C在加热条件下的反应。P溶液和G溶液中具有相同的阳离子。请根据要求回答下列问题:
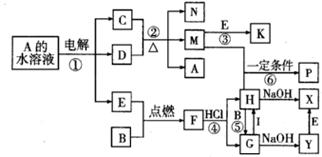
(1)写出I的化学式 。
(2)写出反应①中阴极发生的电极反应式
,
写出反应①的化学方程式
。
(3)写出反应④的离子方程式
,
写出反应⑤的离子方程式
,
写出反应⑥的离子方程式
。
26.(13分)(1)在饱和氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,同时还产生的现象有
① ② 。
用离子方程式表示产生上述现象的原因____________________ 。
(2)在饱和氯化铁溶液中加入一种单质,也会产生类似上述现象的反应,这种单质是( )
A.磷 B.硫 C.镁 D.铜
(3)向物质的量之和为0.1mol 的FeCl3和AlCl3混合溶液中加入90mL 4mol/L的NaOH溶液,使其充分反应。假设原溶液中Al3+ 物质的量与Al3+和Fe3+总物质的量之比为X。
①当X=0.4时,溶液中产生的沉淀是 ,其物质的量为 。
②当沉淀只有Fe(OH)3时,X的取值范围为
27.(10分)2gCu2S和CuS的混合物在酸性溶液中用400 mL0.075mol·L-1 KMnO4溶液处理,发生反应如下:
8MnO4- + 5 Cu2S + 44 H+=10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
6MnO 4- + 5 CuS +28H+=5Cu2+ + 5SO2 + 6Mn2+ + 14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
| |
| |
| |
| |
| |
| |
(2)KMnO4溶液与混合物反应后,剩余 KMnO 4的物质的量为 mol。
(3)欲配制500mL0.1mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M = 392g/mol)的质量为
g。
(4)混合物中Cu2S的质量分数为 。
高三化学第7次测试参考答案
第I卷(选择题,共70分)
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | A | B | C | A | B | B | A | C | D | D |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | C | BD | AB | AD | A | B | D | AC | A |
第II卷(非选择题,共80分)
21.(1)14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O(3分)(2)酸性 氧化性(2分)(3)0.6mol (2分)(4)使用了较浓的硝酸,产物中有部分二氧化氮生成(3分)
![]() 22.答案:⑴反应产生气泡快慢或反应完成的先后或试管壁的冷热程度(2分)控制阴离子相同,排除阴离子的干扰(2分)2H2O2
2H2O+O2↑(2分)⑵分液漏斗(1分)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位(2分);时间(或收集一定体积的气体所需要的时间)。(1分)
22.答案:⑴反应产生气泡快慢或反应完成的先后或试管壁的冷热程度(2分)控制阴离子相同,排除阴离子的干扰(2分)2H2O2
2H2O+O2↑(2分)⑵分液漏斗(1分)关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位(2分);时间(或收集一定体积的气体所需要的时间)。(1分)
23.(1)BD (2)一定有NO3—、Al3+、SO42—;一定无Fe3+、Ba2+、HCO3—
(3)②3Cu+8H++2NO3—=3Cu2++2NO↑+4H2O ③Al3++3NH3·H2O=Al(OH)3↓+3NH4+
④Ba2++SO42—=BaSO4↓(每空2分)
24.(1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu;(2分)
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。(2分)
(2)白色沉淀生成,后沉淀逐渐溶解至消失。(2分,现象完整才给分)
阴极上发生反应:2H++2e- = H2↑使熔液碱性增强,进而发生Al3++3OH- = Al(OH)3↓, Al(OH)3+OH- = AlO2- +2H2O。(4分)
(3)①3MnO2+4Al![]() 3Mn+2Al2O3。 (2分)
3Mn+2Al2O3。 (2分)
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。(2分)
25.(1)![]() (1分,其余方程式为2分)
(1分,其余方程式为2分)
(2)![]()
![]()
(3)![]()
![]()
![]()
26.(1)①有无色无味气体生成(1分) ②溶液颜色变深,产生红褐色胶体(久置有红褐色沉淀)(1分)Fe3++3H2O![]() Fe(OH)3+3H+
(2分) CaCO3+2H+
Fe(OH)3+3H+
(2分) CaCO3+2H+ Ca2++CO2↑+H2O
(1分) (2)C(2分) (3)①Fe(OH)3 (2分) 0.06mol (2分)②0≤X≤0.6 (3分)
27.(1)1、5、8、1、5、4 (2分,其中一个错误得0分)
(2)0.007 (3分)(3)19.6 (2分) (4)40%(3分)