高三化学上学期第一次月考试卷
考生须知:
1.全卷分试卷Ⅰ、Ⅱ和答卷Ⅰ、Ⅱ,试卷共8页,有6大题25小题,满分为100分,考试时间100分钟。
2.本卷答案必须写在答卷Ⅰ、Ⅱ的相应位置上,直接做在试卷上无效。
3.请用钢笔或蓝、黑圆珠笔将班级、姓名、学号、试场号、座位号分别填写在答卷Ⅰ、Ⅱ的相应位置上。考试结束后只需上交答卷Ⅰ、Ⅱ,考试时不能使用计算器。
4.本卷可能用到的相对原子质量:H—1,C—12,N—14,O—16,Mg-24, Al-27,S-32,Fe—56,Cu—64,I-127,W-183.8
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
1.“信息”“材料”“能源”被称为新科技革命的三大支柱。下列有关说法错误的是
A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源
B.目前中、美、日等国掌握的陶瓷发动机技术,大大提高了发动机的转化效率
C.合成高分子材料的广泛应用有百利而无一害
D.B4C3常用于制造切削工具和高温热交换器,它是一种新型无机非金属材料
2.2002年瑞典科学家发现,某些高温油炸食品中含有一定量的![]() (丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:① 能使酸性KMnO4溶液褪色;② 能发生加聚反应生成高分子化合物;③ 只有4种同分异构体;④ 能与氢气发生加成反应。其中正确的是
(丙烯酰胺)。食品中过量的丙烯酰胺可能引起令人不安的食品安全问题。关于丙烯酰胺有下列叙述:① 能使酸性KMnO4溶液褪色;② 能发生加聚反应生成高分子化合物;③ 只有4种同分异构体;④ 能与氢气发生加成反应。其中正确的是
A.①②③ B.②③④ C.①③④ D.①②④
3.下列说法错误的是
A.原子晶体中只存在非极性共价键
B.分子晶体的状态变化,只需克服分子间作用力
C.金属晶体通常具有导电、导热和良好的延展性
D.离子晶体在熔化状态下能导电
4.下列叙述从化学角度分析,其中错误的是
A.被蜜蜂蛰咬后,可涂抹稀氨水或小苏打溶液减轻疼痛
B.HgCl2的稀溶液可用于手术器械消毒,原因是可使蛋白质凝固
C.氟利昂(CCl2F2)或NOx都可破坏臭氧层,而导致“温室效应”
D.燃料煤脱硫后使用,可减少对大气的污染
5.美国科学家用有机分子和球形笼状分子C60,首次制成了“纳米车”(如图),每辆“纳米车”是用一个有机分子和4个球形笼状分子“组装”而成。 “纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
“纳米车”可以用来运输单个的有机分子,生产复杂的材料和药物,成为“纳米生产”中的有用工具。下列说法正确的是
A.我们可以直接用肉眼清晰地看到这种“纳米车”的运动
B.“纳米车”的诞生,说明人类操纵分子的技术进入一个新阶段
C.C60是一种新型化合物
D.C60熔点比金刚石熔点高
6.溶液、胶体和浊液的本质区别是
A.是不是大量分子或离子的集合体 B.分散质微粒直径的大小
C.能否通过滤纸或半透膜 D.是否均一、稳定、透明
7.下列在一定条件下进行的反应属于水解反应的是
① C12H22O11(麦芽糖) + H2O→2C6H12O6 ② CH2=CH2 + H2O →C2H5OH
③ CH3CH2Cl
+ H2O→ CH3CH2OH
+ HCl ④ NH3·H2O![]() NH4+ + OH—
NH4+ + OH—
⑤ CH3CH2ONa + H2O→ CH3CH2OH + NaOH ⑥ CaC2 + 2H2O→Ca(OH)2 + C2H2↑
⑦ FeCl3
+ 3H2O ![]() Fe(OH)3(胶体) + 3HCl
Fe(OH)3(胶体) + 3HCl
A.②④⑦ B.①②⑤⑦ C.③④⑥ D.①③⑤⑥⑦
8.下列有关晶体的叙述中,不正确的是
A.干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子共有6个
B.金刚石的网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
C.氯化钠晶体中,每个Na+周围同时吸引着6个Cl-
D.氯化铯晶体中,每个Cs+周围距离相等且最近的Cs+共有6个
二、选择题(每小题只有一个选项符合题意,共24分)
9.某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是
A.Na+、SO42—、Cl—、 ClO— B. K+、Na+、HCO3—、NO3—
C.H+、Mg2+、SO42—、NO3— D.Ag+、K+、NO3—、Na+
10.下列物质有固定的熔点,且熔点逐渐降低的一组物质是
A.HI、HBr、HCl、HF B.KI、I2、Hg、O2
C.重油、柴油、煤油、汽油 D.石英、食盐、干冰、钾
11.下列反应离子方程式正确的是
A.向氯化铝溶液中加入过量稀氨水:Al3+ + 4OH— == AlO2— + 2H2O
B.向苯酚钠溶液中通入二氧化碳:CO2 + H2O + 2C6H5O— →2C6H5OH + CO32—
C.向小苏打溶液中加入醋酸溶液:HCO3— + CH3COOH == CH3COO— + CO2↑+ H2O
D.向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br— + 2Cl2 == Fe3+ + Br2 + 4Cl—
12.下列各选项所述的两个量,前者一定大于后者的是
① F2和Br2的沸点;② 纯水在25℃和80℃时的pH值;③ 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO4·5H2O的质量;④ 25℃时,等体积的pH值都等于3的盐酸和AlCl3溶液中,已电离的水分子数;⑤ 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数;⑥ 耐火材料MgO和CaO的熔点;⑦ H-和H+离子半径;⑧ 金刚石晶体和石墨晶体中,每个最小碳环里平均所含有的碳原子数
A.①②⑥ B.①②③⑤ C.⑤⑥⑦ D.②⑥⑦
13.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32—
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42—
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
14.下列变化或数据与氢键无关的是
A.SbH3的沸点比PH3高
B.氨分子与水分子形成一水合氨
C.甲酸蒸气的密度在373K时为1.335g·L-1,在293K时为2.5 g·L-1
D.丙酮在己烷和三氟甲烷中易溶解,其中在三氟甲烷中溶解时的热效应较大
15.新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下:
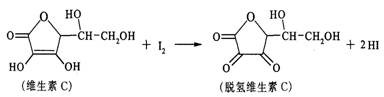
下列说法正确的是
A.上述反应为取代反应 B.维生素C在酸性条件下水解只得到1种产物
C.维生素C不溶于水,可溶于有机溶剂 D.维生素C的分子式为C6H10O6
16.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)
![]() xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。
下列说法正确的是
① 若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定增大
② 若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
③ 若x=2,则Ⅱ体系起始物质的量应当满足3 n(B) =n(A)+3
④ 若Ⅱ体系起始物质的量当满足3 n(C) +8n(A)==12 n(B)时,可断定x=4
A.①② B.①④ C.②③ D.③④
第Ⅱ卷(非选择题 共60分)
三、(本题包括3小题,共20分)
17.(8分)2gCu2S 和CuS 的混合物在酸性溶液中用400mL0.075mol /L KMnO 4溶液处理,发生反应如下:8MnO 4-+5 Cu2S+44H+=10Cu 2++5SO 2+8Mn 2++22H2O;
6MnO 4-+5 CuS+28H+=5 Cu 2++5SO 2+6Mn 2++14H2O。反应后煮沸溶液,赶尽SO2,剩余的KMnO 4恰好与350mL0.1mol/L(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]() MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
MnO 4-+ Fe2+ + H+= Mn2++ Fe3++ H2O;
(2)KMnO 4溶液与混合物反应后,剩余KMnO 4的物质的量为 ▲ mol;
(3)欲配制500mL0.1 mol /L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 ▲ g;
(4)混合物中Cu2S的质量分数为 ▲ 。
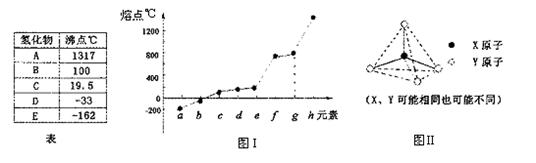
|
(1)短周期元素中,原子的最外层电子数与电子层数相等的元素有 ▲ 种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如上表所示,则A的晶体类型是 ▲ ,C与D发生反应的化学方程式为 ▲ 。
(3)第三周期元素单质的熔点变化如图I所示,则g元素的名称为 ▲ ,写出工业上冶炼h的化学方程式 ▲ 。
 (4)分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。写出甲、乙反应的离子方程式
▲
。
(4)分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。写出甲、乙反应的离子方程式
▲
。
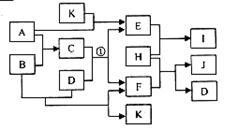
19.(6分)右图中各物质均由常见元素(原子序数
≤20)组成。已知A、B、K为单质,且在常温
下A和K为气体,B为固体。D为常见的无色
液体。I是一种常用的化肥,在其水溶液中滴加
AgNO3溶液有不溶于稀HNO3的白色沉淀产生。J是一种实验室常用的干燥剂。它们的相互转化关系如右图所示(图中反应条件未列出)。请回答下列问题:
(1)I的化学式为 ▲ ,J的电子式为 ▲ ;
(2)反应①的化学方程式为 ▲ ;
(3)F的水溶液与氯气反应的离子方程式为 ▲ 。
四、(本题包括2小题,共16分)
20.(6分)可用于分离或提纯物质的方法有:A、分馏 B、盐析 C、过滤 D、重结晶 E、升华 F、渗析 G、电解 H、加热分解 I、蒸馏 J、灼热氧化。如欲分离或提纯下列各组混合物,请选择上述方法中最合适者(填相应字母)填空:
(1)从石油中分离出汽油和煤油等成分 ▲ ;
(2)除去淀粉溶液中的少量碘化钠 ▲ ;
(3)从油脂皂化反应后的混合液中分离出高级脂肪酸钠 ▲ ;
(4)除去粗铜中锌、银等金属 ▲ ;
(5)除去水中的Na+、SO![]() 、Cl-等杂质 ▲ ;
、Cl-等杂质 ▲ ;
(6)除去KNO3晶体中混有的少量NaCl ▲ 。
21.(10分)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I—作用定量析出I2,I2溶于过量的KI溶液中:
I2 + I-==I3-,又知氧化性:Fe3+ > Cu2+ > I2 > FeF63-;析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32- + I3- ==S4O62- + 3I-。
操作:准确称取ag胆矾试样(可能含少量 Fe2(SO4)3),置于250mL碘量瓶(带磨口塞的锥形瓶)中,加50mL蒸馏水、5mL3mol/LH2SO4溶液,加少量NaF,再加入足量的10%KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5min,充分反应后,加入1~2mL0.5%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去VmL标准液。
(1)实验中,在加KI前需加入少量NaF,推测其作用可能是 ▲ ;
(2)实验中加入硫酸,你认为硫酸的作用是 ▲ ;
(3)本实验中用碘量瓶而不用普通锥形瓶是因为 ▲ ;
(4)硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为 ▲ ;
(5)根据本次实验结果,该胆矾试样中铜元素的质量分数ω(Cu)= ▲ 。
五、(本题包括2小题,共12分)
22.(6分)克矽平是一种治疗矽肺病的药物,其合成路线如下(反应均在一定条件下进行):
 |
试回答下列问题:
 (1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应
(1)化合物Ⅰ的某些性质类似苯。例如,化合物Ⅰ可以一定条件下与氢气发生加成反应
生成 ,其反应方程式为 ▲ (不要求标出反应条件);
(2)化合物I生成化合物Ⅱ是原子利用率100%的反应,所需另一种反应物的分子式为
▲ ;
(3)下列关于化合物Ⅱ和化合物Ⅲ的化学性质,说法正确的是 ▲ (填字母);
A.化合物Ⅱ可以与CH3COOH发生酯化反应
B.化合物Ⅱ不可以与金属钠生成氢气
C.化合物Ⅲ可以使溴的四氯化碳溶液褪色
D.化合物Ⅲ不可以使酸性高锰酸钾溶液褪色
(4)化合物Ⅲ生成化合物Ⅳ的反应方程式为 ▲ (不要求标出反应条件);
(5)用氧化剂氧化化合物Ⅳ生成克矽平和水,则该氧化剂为 ▲ 。
23.(6分)下图中A、B、C、D、E、F、G均为有机化合物。
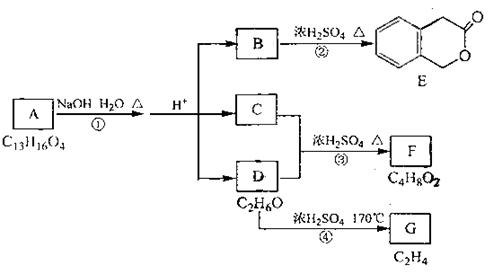
根据上图回答问题:
(1)B的分子式是 ▲ ,A的结构简式是 ▲ ,反应①的反应类型是 ▲ ;
(2)符合下列3个条件的B的同分异构体的数目有 ▲ 个。
i)含有邻二取代苯环结构、ii)与B有相同官能团、iii)不与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式 ▲ ;
(3)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途 ▲ 。
六、(本题包括2小题,共12分)
24.(6分)下图是金属钨及从金属钨晶体中划分出的一个晶胞(晶体中仍保持一定几何形状的最小单位)的结构模型。它是一个立方体,立方体中每个角各有一个钨原子,中心有一个钨原子。若实验测得晶胞的边长a = 3.16×10-8cm,式量为183.8,阿伏伽德罗常数为NA= 6.02×1023mol-1。
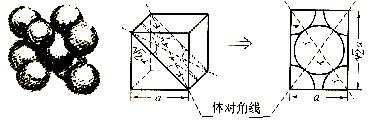
假定金属钨原子为等直径的刚性球,采取上述方式的紧密堆积。通过计算回答下列问题:
(1)每一个晶胞中分摊到几个钨原子?
(2)钨原子的半径?(提示:只有立方体对角线上各个球才是彼此两两相切的)
(3)金属钨的密度?
25.(6分)将5.1 g镁铝合金溶于600 mL 0.5 mol·L-1H![]() SO
SO![]() 溶液中,完全溶解后再加入
溶液中,完全溶解后再加入
1.0 mol·L-1的NaOH溶液,得到沉淀的质量为13.6 g,继续滴加NaOH溶液时则沉淀会减少。
(1)当加入
▲ mLNaOH溶液时,可使溶解在硫酸中的Mg![]() 和Al
和Al![]() 恰好完全沉淀。
恰好完全沉淀。
(2)计算合金溶于硫酸时所产生的氢气在标准状况下的体积。(列出算式)
高三第一次月考化学评分标准
第I卷(选择题 共40分)
一、选择题(每小题只有一个选项符合题意,共16分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | D | A | C | B | B | D | A |
二、选择题(每小题只有一个选项符合题意,共24分)
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | A | B | C | D | C | A | B | D |
第Ⅱ卷(非选择题 共60分)
三、(本题包括3小题,共20分)
17.(8分)(1)1、5、8、1、5、4 (2)0.007 (3)19.6 (4)40% (各2分)
|
(3)铝(1分),SiO2 + 2C === 2CO + Si(1分);
![]() (4)NH4+ + H2O NH3·H2O + H+(1分)
(4)NH4+ + H2O NH3·H2O + H+(1分)
19.(6分)(1)NH4Cl(1分),CaCl2电子式略(1分);
(2)Ca3N2 + 6H2O == 3Ca(OH)2 + 2NH3↑;(2分)
(3)Cl2 + 2OH- == ClO— + Cl- + H2O (2分)
四、(本题包括2小题,共16分)
20.(6分)(1)A (2)F (3)B (4)G (5)I (6)D (各1分)
21.(10分)(1)掩蔽Fe3+,防止造成偏大的误差(2分)
(2)提供酸性环境抑制铜离子水解(2分)
(3)防止空气中氧气氧化碘化钾;防止碘升华 (2分)
(4)2Cu2++4I-===2CuI↓+I2 (2分)
(5)![]() (2分)
(2分)
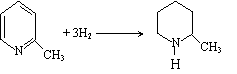 五、(本题包括2小题,共12分)
五、(本题包括2小题,共12分)
22.(6分)(1) (1分)
(2)CH2O(答HCHO也得分)(1分) (3)A、C (2分)
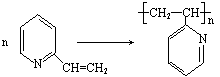
(4) (1分)(5)H2O2(或双氧水、过氧化氢)(1分)
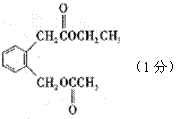 |
23.(6分)(1)C9H10O3 (1分) 水解反应 (1分)
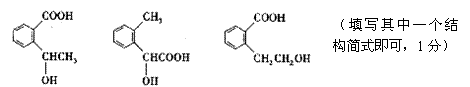 (2)3(1分)
(2)3(1分)
 |
六、(本题包括2小题,共12分)
24.(6分)(1)每个晶胞中含有的钨原子数为8×1/8+1=2
(2) r ≈ 1.37×10—8cm。
(3)![]() ,ρ≈19.30 g/cm3。(各2分)
,ρ≈19.30 g/cm3。(各2分)
25.(6分) (1)600 (2分)
(2)据题意,作下图示:
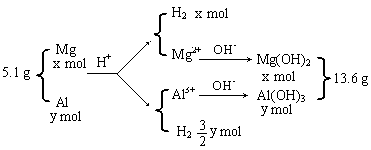
![]()
![]() 列式: 24x+27y=5.1 解得: x=0.1
列式: 24x+27y=5.1 解得: x=0.1
58x+78y=13.6 y=0.1 (3分)
氢气的体积为:(0.1+![]() ×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。
×0.1)×22.4=5.6(L)(1分) 其它合理解法参照给分。