08届高三化学上学期第十三周周日测试题
内容:电化学 编者:麦达勤
本试卷分第I卷(选择题)和第II卷(非选择题)两部分。本卷满分150分。
可能用到的原子量:K39 Cu 64 Zn 65 Ag 108
第一部分 选择题(共70分)
 一.选择题(本题包括10小题,每小题3分共30分,每小题只有一个答案正确)
一.选择题(本题包括10小题,每小题3分共30分,每小题只有一个答案正确)
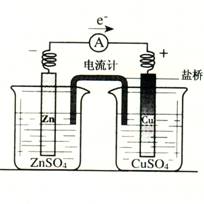
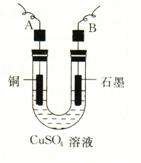
1.有关如右图所示原电池的叙述,正确的是(盐桥中装有含琼胶的KCl饱和溶液)
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
2.在钢铁腐蚀过程中,下列五种变化可能发生的是
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质碳被氧化
 A.只①② B.只②③④
A.只①② B.只②③④
C.①②③④ D.①②③④⑤
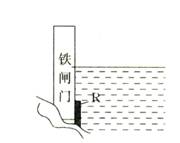
3.为了降低某水库的铁闸门被腐蚀的速率,可以采取如右图所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
4.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);△ H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(1)+8H2O(1);△ H>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△ H<0
D.CH4(g)+2O2(g)→CO2(g)+2H2OH(1);△ H<0
5.在铅蓄电池充、放电的过程中,发生还原反应的电极是
A.充电时的阴极和放电时的负极 B.充电时的阴极和放电时的正极
 C.充电时的阳极和放电时的负极 D.充电时的阳极和放电时的正极
C.充电时的阳极和放电时的负极 D.充电时的阳极和放电时的正极
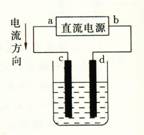
6.下图是电解CuCl2溶液的装置,其中c、d均为石墨电极,则下列有关判断正确的是
A.a为负极,b为正极
B.a为阴极,b为阳极
C.电解过程中,氯离子浓度不变
D.电解过程中,d电极覆盖上一层红色物质
7.下列反应的离子方程式书写正确的是
A.浓烧碱溶液中加入铝片:Al + 2OH-=AlO2-+H2↑
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O ![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
8.下列关于铜电极的叙述正确的是
A.电解稀硫酸制H2、O2时铜作阳极
B.用电解法精炼精铜时粗铜作阴极
C.在镀件上电镀铜时可用金属铜作阴极
D.铜锌原电池中铜是正极
9.对于冶炼像钠、钙、镁、铝这样活泼的金属,电解法几乎是唯一可行的工业方法。下列有关说法中正确的是
A.电解熔融NaOH可生成金属钠、O2以及H2
B.电解熔融Al2O3制备金属铝时,要加入冰晶石,使Al2O3在较低温度下熔解
C.可用电解饱和MgCl2溶液的方法获得金属镁
D.电解熔融CaCl2时,金属钙在阳极生成
10.某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
![]()

A.铅笔端作阳极,发生还原反应 B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生 D.a点是负极,b点是正极
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得4分,但只要选错一个,该小题就为0分)
11.用惰性电极电解下列溶液一段时间,再加入一定量的另一种纯净物(方括号内);能使电解后溶液与原来溶液的成分、浓度相同的是(假定产生的气体逸出)
A.CuCl2[CuCl2] B.NaOH[NaOH]
C.NaCl[HCl] D.CuSO4[Cu2(OH)2CO3]
12.某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)2溶液组成的原电池
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以KOH为电解质,电池总反应式为: Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。下列说法错误的是
A.电池工作时,锌失去电子
B.电池负极的电极反应式为:MnO2+H2O+e—===MnOOH+OH—
C.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
D.锌锰碱性电池是二次电池,所以性能比普通锌锰电池好
14.如图所示,下列叙述正确的是
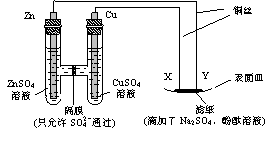

A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
15.用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,且已知Fe2(SO4)3+Cu===2FeSO4+CuSO4,下列说法正确的是
A.阴极反应式为:Cu2++2e—====Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.首先被电解的是Fe2(SO4)3溶液,后被电解的是CuSO4溶液
D.阴极上不可能析出铜
16.用铂电极分别电解KCl溶液和K2SO4溶液时,都会出现的现象或实验结果是
A.溶液中K+离子浓度都不变
B.溶液的pH都不变
C.阳极上都生成能使湿润的碘化钾淀粉试纸变成蓝色的气体
D.阴极上都生成可燃的气体
17.天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6![]() CoO2+LiC6,下列说法正确的是
CoO2+LiC6,下列说法正确的是
A.充电时,电池的负极反应为LiC6-e- = Li++C6
B.放电时,电池的正极反应为CoO2+Li++e- = LiCoO2
C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
18.若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是 2Ag+2H+===2Ag++H2 ↑,则下列关于该装置的有关说法正确的是
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属银为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
19.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是
(已知:氧化性Fe2+<Ni2+<Cu2+)
A.阳极发生还原反应,其电极反应式:Ni2++2e-===Ni
B.电解过程中,阳极质量减少与阴极质量增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
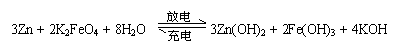 20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
下列叙述不正确的是
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO![]() + 4H2O
+ 4H2O
C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
D.放电时正极附近溶液的pH减小
第二部分 非选择题(共80分)
三.(本题包括4小题,共31分)
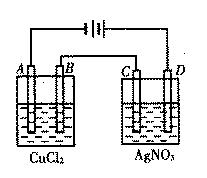 21(6分)右图为以惰性电极进行电解:
21(6分)右图为以惰性电极进行电解:
(1)写出A、B、C、D各电极上的电极方程式:
A________________________________
B________________________________
C________________________________
D________________________________
(2)在A、B、C、D各电极上析出生成物的物质的量比为______________________。
22(6分)一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu====2Fe2++Cu2+,可以写成:氧化反应 Cu—2e—====Cu2+;还原反应 2Fe3++2e—====2Fe2+。
(1)根据以上信息将反应3NO2+H2O===2H++2NO3—+NO拆分成两个“半反应式”:氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH——8e—====CO32—+7H2O;O2+2H2O+4e—
====4OH—,则总反应式为 。
23(7分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
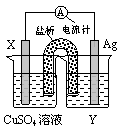

请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极,发生的电极反应为______________________________;
X电极上发生的电极反应为____________________________;
(3)外电路中的电子是从_______电极流向________电极。
24(12分) A.采用惰性电极从NO3-、SO42-、H+、Cu2+、Ba2+、Ag+、Cl-某离子中,选出适当的离子组成电解质,对其溶液进行电解:
(1) 两极分别放出H2和O2,电解质的化学式是____________.
(2) 阴极析出金属,阳极放出O2,电解质的化学式是___________.
(3) 两极分别放出气体,且体积比为1:1,电解质的化学式是_________.
B.用碳棒作电极,电解下列水溶液:①Na2SO4溶液②AgNO3溶液③KCl溶液④CuCl2溶液。
(1)通过相同电量时,阴极产生的气体的物质的量相同的是_____________。
(2)通过相同电量时,产生的气体总的物质的量由多到少排列顺序是______。
四.(本题包括2小题,共20分)
25(8分)某课外活动小组研究电解饱和食盐水。甲、乙两位同学均采用了以下仪器和试剂:烧杯、直流电源、铁钉、碳棒、导线以及滴加了两滴酚酞试液的饱和NaCl溶液。
(1)甲同学设计的电解装置中,铁钉与直流电源的负极相连。通电后,很快可以观察到铁钉附近出现的现象为 。但继续通电下,不久该现象就会消失,你认为其中的原因是 。
甲同学的电解实验中,阳极反应式为 ,阴极反应式为
。
(2)乙同学设计的电解装置中,铁钉与直流电源的正极相连。若通电后,预期铁钉附近出现的现象为 。
26(12分)已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下:
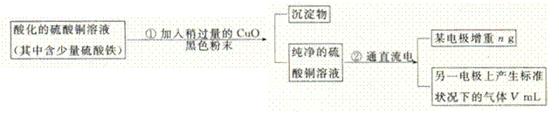 回答下列问题:
回答下列问题:
 (1)加入CuO的作用是
。
(1)加入CuO的作用是
。
(2)步骤②中所用的部分仪器如下图所示,则A、B分别连直流电源的 和 极(填“正”或“负”)。
(3)电解开始后,在U形管中可以观察到的现象有:
。电解的离子方程式为 。
(4)下列实验操作中必要的是 (填写字母)。
(A)称量电解前的电极的质量;(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;(C)刮下电解后电极上析出的铜,并清洗,称量;(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有m、V的计算式表示)。
五(本题包括2小题,共23分)
27(11分)某化学兴趣小组利用细废铁屑制取FeCl3•6H2O晶体。主要步骤如下:
① 往工业废铁屑中加入适量的纯碱溶液,加热数分钟,用倾析法洗净废铁屑。
② 洗净后的废铁屑放在烧杯内,用过量的工业盐酸浸泡至不再产生气泡,过滤。
③ 按下图组装仪器,并检查装置的气密性,将②得到的滤液放入试剂瓶B中。
④ 在石墨电极X、Y上连接直流电源,通电,待FeCl2全部被氧化后,断开电源。
⑤ 试剂瓶B中的溶液经过一系列操作,可得FeCl3•6H2O晶体。
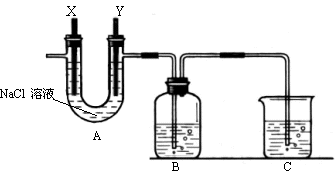
请回答下列问题:
(1)步骤①的目的是
,其中加热的作用是
。
(2)A中的X极应连接电源的 极;B中溶液颜色的变化 ,
反应离子方程式是
。
(3)为检验B中FeCl2已全部转化为FeCl3,可以选用的试剂是 。
A、溴水 B、酸性KMnO4溶液 C、KSCN溶液 D、NaOH溶液
(4)在整个实验过程中,盐酸必须保持过量,主要原因是 。
(5)C中的烧杯应该盛放的是 。
(6)由步骤⑤试剂瓶B中的溶液制得FeCl3•6H2O晶体,需要进行的操作依次是(填序号) 。
A、加热浓缩
B、洗涤
C、过滤 D、冷却结晶
28(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 | |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应____________________________________;
化合反应____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与钦锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示) ___________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。
六(本题包括1小题,共6分)
29 (6分)(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应:_____________________________________;
银片上发生的电极反应:______________________________________。
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);
②通过导线的电量。(已知NA = 6.02×1023 /mol,电子电荷为1.60×10-19 C)
附加题(10分,奥赛班必做,平行班选做)
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3 = 6K2O+N2),39.0 g钾与10.1 g硝酸钾充分反应生成K2O的质量为__ g。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2 = 2K2CO3+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2 L(标准状况)CO2和KO2反应后,气体体积变为18.8 L (标准状况),反应消耗的KO2的质量为
(4)KO2加热至600 ℃部分分解得到产物A。6.30 g产物A充分吸收二氧化碳生成碳酸钾并产生氧气1.12 L(标准状况),试确定产物A中钾氧两种原子个数之比。如果产物A只含有两种化合物,写出所有可能的化学式并计算A中两种化合物的物质的量之比。(写计算过程)
(06高考四川理综11)下列描述中,不符合生产实际的是
A.电解熔融的氧化铝制取金属铝,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
高三化学班第十三周周日测
1-5 A C C D B 6-10 D C D B D
11-15 AC CD BD A C
16-20 D B C D AD
三.(本题包括4小题,共31分)
21.(6分)
(1)Cu2++2e-==Cu; 2C1--2e-==C12; 4OH--4e-==2H2O+O2↑; 2Ag++2e-==2Ag(各1分)
(2)2∶2∶4∶1(2分)
22.(6分,每空2分)
(1)2NO2+2H2O—2e—===2NO3—+4H+
NO2+2H++2e—====NO ↑+H2O
(2)CH4+2O2+2OH—====CO32—+3H2O
23.(7分,每空1分) (1)铜(或Cu);AgNO3溶液。 (2)正, Ag++e- = Ag;
Cu-2e- = Cu2+。 (3)负(Cu);正(Ag)
24 (12分) A.(1)H2SO4、Ba(NO3)2、HNO3 (3分)
(2)AgNO3、CuSO4、Cu(NO3)2 (3分)
(3)HCl、BaCl2 (2分)
B、(1)①③ (2分)
(2)③①④② (2分)
四.(本题包括2小题,共20分)
25.(8分)
(1)无色溶液变成红色(2分);
阳极上生成的Cl2和阴极上生成的NaOH发生反应,生成的NaClO具有漂白作用(2分);
2Cl——2e—====Cl2 ↑(1分);
2H++2e—===H2 ↑(或写成2H2O+2e—===H2↑+2OH—,1分)
(2)生成白色沉淀,而且该沉淀很快变成灰绿色,最终变成红褐色(2分)
26.(12分)通过消耗H+而调整溶液的pH使之升高,其目的是使Fe3+完成水解形成Fe(OH)3沉淀而除去(2分)
(2)负;正(各1分)
(3)石墨上有气泡逸出,溶液颜色变浅(2分)
2Cu2++2H2O![]() 2Cu↓+O2 ↑+4H+
(2分)
2Cu↓+O2 ↑+4H+
(2分)
(4)A、B、D、E(2分。全对给2分,只答2个或3个且正确的给1分,只答1个0分。只要选择C,该空就为0分)
(5)11200n/ V (2分)
五(本题包括2小题,共23分)
27(11分)
(1)除去铁锈表面的油污;促进Na2CO3水解,加快除去油污的速度(2分)
(2)负极;浅绿色变成棕黄色 ;2Fe2++Cl2=2Fe3++2Cl—(3分)
(3) B (1分)
(4)使铁屑完全溶解;抑制Fe3+的水解,保证产物的纯度 (2分)
(5)NaOH溶液(或其他碱溶液) (1分)
(6)A、D、C、B (2分)
28.(12分)
(1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu; (2分)
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。(2分)
(2)白色沉淀生成,后沉淀逐渐溶解至消失。 (2分)
Al3++3OH- = Al(OH)3↓,(1分)
Al(OH)3+OH- = AlO2- +2H2O。(1分)
(3)①3MnO2+4Al![]() 3Mn+2Al2O3。 (2分)
3Mn+2Al2O3。 (2分)
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。(2分)
六(本题包括1小题,共6分)
29.(6分) (1)Zn-2e- = Zn2+(1分); 2H++2e- = H2↑(1分)。
(2) (4分)
Zn+2H+ = Zn2++H2↑ ~ 转移2e-
![]() =
= ![]() =
=![]()
得V(H2) = 4.5 L; Q = 3.8×104 C。
附加题(10分,奥赛班必做,平行班选做)
(1)28.2 g(1分)。 (2)96.25%(1分)。 (3)71 g(1分)。
(4) KxOy+x/2CO2 = x/2K2CO3+(y-0.5x)/2O2
![]() =
= ![]()
解得x:y=2:3,即n(K):n(O)=2:3。(合理即给分) (3分)
即得化学式为:n(KO2):n(K2O2) = 2:1(2分),n(KO2):n(K2O) = 4:1。(2分)