08届高三化学上册第七次双周练试卷
命题人:王娟 审核人:张德发
可能用到的原子量:H 1 C 12 O 16 Na 23 S 32 K 39 Al 27
Ca 40 Cu 64 Mg 24 Fe 56 N 14
第Ⅰ卷(48分)
一、选择题(本题共8小题,每小题3分,共24分,只有一个正确选项。)
 1.瑞典皇家科学院诺贝尔奖委员会将2007年度诺贝尔化学奖授予德国科学家格哈德·埃特尔(Gerhard
Ert1),以表彰他在“固体表面化学过程”研究中作出的贡献。下列有关说法正确的是
1.瑞典皇家科学院诺贝尔奖委员会将2007年度诺贝尔化学奖授予德国科学家格哈德·埃特尔(Gerhard
Ert1),以表彰他在“固体表面化学过程”研究中作出的贡献。下列有关说法正确的是
A.汽车尾气中CO可在固体催化剂表面转为C02
B.合成氨中N2和H2以物质的量之比3:l在催化剂表面进行
C.氢氧燃料电池的电极均作为反应物参加电极反应
D.臭氧空洞的形成与化石燃料大量使用有关
2.正确掌握化学用语和化学基本概念是学好化学的基础。下列有关表述中正确的一组是
A.![]() Bi和
Bi和![]() Bi都含有83个中子
Bi都含有83个中子
B.16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体
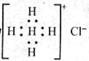
 C.SiH4、PH3、HCl的稳定性逐渐增强
C.SiH4、PH3、HCl的稳定性逐渐增强
D.Ca2+的结构示意图为 NH4Cl的电子式为
3.下列有关物质类别判别的依据正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
4.已知:(NH4)2C03(s)=NH4HC03(s)+NH3(g) △H=+74.9 KJ.mol-1。,下列说法中正确的是
A.该反应是吸热反应,因此一定不能自发进行
B.该反应中熵变、焓变皆大于O
C·碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发
D·能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
5.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g) ;△H>0
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ;△H<0
C.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l); △H>0
D.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) ;△H<0
6.可逆反应m
A(g) + n B(g) ![]() pC(g)
+ g D(g) 的v ~
t图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v~t图像如下右图。
pC(g)
+ g D(g) 的v ~
t图像如下左图,若其它条件都不变,只是在反应前加入合适的催化剂,则其v~t图像如下右图。
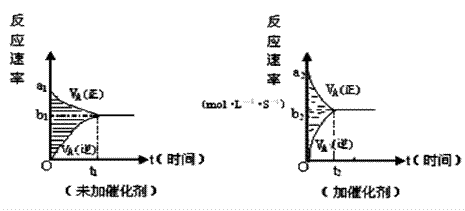
①a1 = a2 ②a1 < a2 ③b1 = b2 ④b1 < b2 ⑤t1>t2 ⑥t1= t2
⑦两图中阴影部分面积相等 ⑧右图阴影部分面积更大
以上正确的为
A.②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
7.下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)![]() 2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s)![]() C(金刚石,s);△H>0,则金刚石比石墨稳定
C(金刚石,s);△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(ag)+HCl(ag)==NaCl(ag)+H2O(l);△H=-57.4kJ/mol
D.己知2C(s)+2O2(g)=2CO2(g); △H1 2C(s)+O2(g)=2CO(g); △H2 则△H1>△H2
8.关于下列各装置图的叙述中,不正确的是
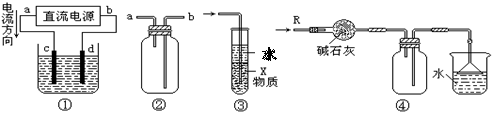 |
A.装置①中,d为阳极、c为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
二、选择题(本题共6小题每小题4分,共24分,每题有1-2个选项,错选不得分,漏选得1分)
9.Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中不正确的是
A.Na2O2在反应中只作氧化剂
B.O2是氧化产物
C.Na2FeO4既是氧化产物又是还原产物
D.有2mol FeSO4参加发生反应时,反应中共有8mol电子转移
10.能正确表示下列反应的离子方程式是
A.足量铁与稀硝酸反应:Fe+4H++NO3-=Fe2++4H2O+NO↑
B.足量硫化氢气体通入硫酸铁溶液中:H2S+Fe3+=Fe2++S↓+2H+
C.醋酸溶液与纯碱反应:CO32- +2H+=+H2O+CO2↑
D.等物质的量的Ba(OH)2与NaHSO4在溶液中反应:
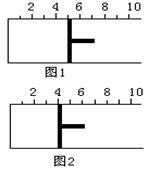 Ba2++OH-+H++SO42-=BaSO4↓+H2O
Ba2++OH-+H++SO42-=BaSO4↓+H2O
11.如右图所示,一定条件下将1mol A2气体和3molB2气体充入一
容积可变的密闭容器中,可滑动的活塞的位置如图1所示。在
![]() 恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3
恒温恒压下发生如下反应:A2(g)+3B2(g)2AB3
(g)。当反应达到平衡时,活塞位置如图2所示,则平衡时A
的转化率是
A.20% B.60% C.40% D.无法确定
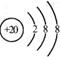
12.钡在氧气中燃烧时得到一种钡的氧化物晶体, 结构如下图所示, 有关说法正确的是
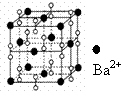 A.该晶体属于离子晶体
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有12个
13.现有下列四个图像:
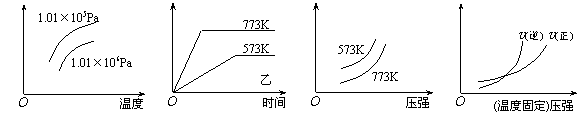 |
下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g)![]() 2NH3(g);△H=-Q1 kJ/mol(Q1>0)
2NH3(g);△H=-Q1 kJ/mol(Q1>0)
B.2SO3(g)![]() 2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g)![]() 4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
4NO+6H2O(g);△H=-Q3 kJ/mol(Q3>0)
D.H2(g)+ CO(g)![]() C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
C(s)+H2O(g);△H=+Q4 kJ/mol(Q4>0)
14.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱时,过量B跟氯气反应除生成C外,另一产物是盐酸盐。
A![]()
下列说法不正确的是
A. 当X是强酸时,ABCDEF均含有一种元素,F是硫酸
B. 当X是强碱时,ABCDEF均含同一种元素,F是硝酸
C. B和Cl2的反应是非氧化还原反应
D. 当X是强酸时,C常温下是气态单质
第Ⅱ卷(72分)
三、实验题(本题包括2小题,共21分)
15. (6分)下列有关实验或原理的叙述,不正确的是(填序号)
A·用分液漏斗进行分液操作,下层液体从下口放出后,换一烧杯,上层液体继续从下口放出
B·中和热的测定实验用环形玻璃搅拌棒而不用铜丝搅拌棒的原因是减少热量的损失
C·配制一定浓度的硫酸时,先往容量瓶中加水,然后按计算结果将一定体积的浓硫酸沿玻璃棒注入容量瓶,然后加水至刻度,摇匀
D.从溴的四氯化碳溶液中提取溴,可用苯进行萃取
E.只用水一种试剂就能将CuSO4、Na2C03、CaC2三种固体粉末鉴别
F·用NaOH溶液和FeSO4,溶液制备Fe(OH)2时,吸有NaOH溶液的胶头滴管末端应插入FeSO4溶液液面之下
16.(15分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式。
正极反应 ,
负极反应 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤:
。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu | ||
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式 、
劣质不锈钢腐蚀的实验现象: 。 四、推断题(本题1小题,共10分)
17.(10分)已知A、B、C为常见的单质,在一定条件下相互转化的关系如图:(有部分物质省略)
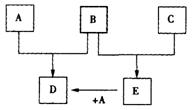
(1)若常温下,A、B均为气体,C为红色固体,E为黑色固体,则E的化学式为_____,写出A+E→D的化学反应方程式___________________________________________。
(2)若常温下B、C均为气体,A为金属单质,D为黑色晶体,则E的电子式为______ ,写出A+E→D的化学反应方程式 ______________________________________________。
(3)若常温下B为气体,C为黑色固体,则金属A的原子结构示意图为_____ _ ,写出A+E→D的化学反应方程式____________________________________________。
五、填空题(本题包括3小题、共33分)
![]() 18.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
18.(10分)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2 + C+ N2 Si3N4 + CO
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应的平衡常数表达式为K= ;
(4)若知上述反应为放热反应,则其反应热△H 零(填“大于”、“小于”或“等于”);升高温度,其平衡常数值 (填“增大”、“减小”或“不变”);
(5)若使压强增大,则上述平衡向 反应方向移动(填“正”或“逆”);
(6)若已知CO生成速率为v(CO)=18mol/(L.min),
则N2消耗速速率为v(N2)= mol/(L.min)。
19.  (11分)二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(11分)二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
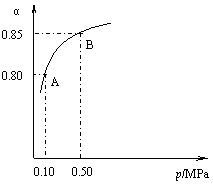
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。根据图示回答下列问题:
① 将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 。
② 平衡状态由A变到B时,平衡常数
K(A) K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为
阿伏伽德罗常数用NA表示),放出的热量为 kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=MN、CO、ZN或NI)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
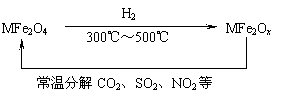 |
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
 “减小”或“不变’’)。
“减小”或“不变’’)。
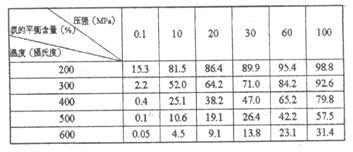
②不同温度、压强下,合成
氨平衡体系中NH3的物质的
量分数见下表(N2和H2的
起始物质的量之比为1:3).
分析表中数据, ℃
MPa时H2转化率最高,实际工业生产不选用该条件的主要原因是 。
③下列关于合成氨说法正确是 。(填字母)
A.使用催化剂可以提高NH3的产率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于ΔH<0,ΔS>O故合成氨反应一定能自发进行
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。它既有液氢燃料电池的优点,又克服了液氢不易保存的不足。其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气。其电池反应为4NH3 +302=2N2+6H20。你认为电解质溶液应显 性(填“酸性”、“中性"、“碱性”), 其原因是 ,写出负极电极反应式 。
六、计算题(本题包括1小题,共8分。)
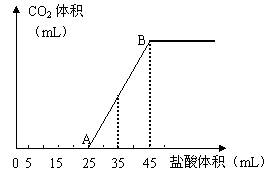
21.(9分)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式____ _______________________________。
(2)当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数。
 |
第七次双周练化学试卷(答题纸)
第Ⅰ卷(选择题)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
|
|
|
|
|
|
|
|
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 |
|
|
| 答案 |
|
|
|
|
|
|
|
|
第Ⅱ卷(非选择题)
三、实验题(本题包括2小题,共21分)
15.
16(1)
(2)
(3)
(4) 、
四、推断题(本题1小题,共10分)
17(1)
(2)
(3)
五、填空题(本题包括3小题、共33分)
18(1)配平上述反应的化学方程式(将化学计量数填在方框内);
SiO2 + C+ N2 = Si3N4 + CO
(2) 、
(3)
(4) 、
(5)
(6)
19. (1)① ②
(2)
(3)
20(1)① ②
③
(2)
六、计算题(本题包括1小题,共8分。)
(1)
(2)
(3)
1--14选择题答案为红色部分
15.ACD
16.(1)2Fe3++Cu=2Fe2++Cu2+
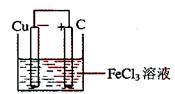 (2)装置图
(2)装置图
正极反应:Fe3++e-=Fe2+(或2Fe3++2e-=2Fe2+)
负极反应:Cu=Cu2++2e-(或Cu-2e-=Cu2+)
(3)①通入足量氯气将Fe2+氧化成Fe3+;②加入CuO调节溶液的pH至3.2~4.7;
③过滤[除去Fe(OH)3]
(4)CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu,不锈钢表面有紫红色物质生成。
17.(10分)(1) E:CuO,(2分)H2+CuO![]() Cu+H2O。 (2分)
Cu+H2O。 (2分)
(2)
E:![]() (1分),3Fe+4H2O(g)
(1分),3Fe+4H2O(g) ![]() Fe3O4+4H2。 (2分)
Fe3O4+4H2。 (2分)
(3)
A: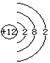 (1分),2Mg+CO2
(1分),2Mg+CO2![]() 2MgO+C。(2分)
2MgO+C。(2分)
18.答案:(1)3,6,2,1,6
![]() (2)N2,Si3N4
(2)N2,Si3N4
(4)小于;减小
(5)逆
(6)6
19.(1)①800L·mol-1 ② = (2)1.60NA,173.4
(3)MFe2Ox+SO2→MFe2O4+S
20.(1)① 减小②200 100 ③B
(2)碱性 2NH3-6e+6OH-=N2+3H2O
21.(1) H++OH-=H2O H++CO32-=HCO3-
(2)224
(3) 0.6 42.4