08届高三化学上册第三次月考试卷
相对原子质量:Na-23;Cl-35.5;Cu-64;Ag-108;Fe-56;S-32;K-39;Cr-52;Ba-137
一、选择题(每小题只有一个选项正确,共2×20=40分)
1、2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔是因为他在表面化学所作的开创性研究,他的方法不仅被用于学术研究而且被用于化学工业研发。下面选项与物质的表面特性无关的是
A、合成氨用铁粉做催化剂 B、用明矾来净水
C、用还原铁粉和石棉绒混合物与水蒸气制得Fe3O4和H2
D、配制FeCl3 溶液时将FeCl3固体溶于浓盐酸中再加水稀释
2、能保存在带磨口玻璃塞的无色试剂瓶中的物质是
A、.氟化钠溶液 B、浓硝酸 C、氯化铝溶液 D、碳酸钠溶液
3、有关热化学方程式书写与对应表述均正确的是
A、稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l);△H=-57.3KJ/mol
|
热量。则Fe(s)+S(s)==FeS(s) ;△H=-95.6KJ/mol
C、氢气的燃烧热为285.5 KJ/mol,则水电解的热化学方程式:
![]() 2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
2H2O(l) 2H2(g)+O2(g);△H=+285.5 KJ/mol
D、已知2C(s)+O2(g)=CO(g) ;△H=-221 KJ/mol,则可知C的燃烧热为110.5 KJ/mol
4、下列有关说法中,正确的是
A、溶液中c(H+)越大,pH值也越大,溶液的酸性就越强
B、pH=3和pH=4的盐酸各10mL混合,所得溶液的pH=3.5
C、三种氢化物的沸点高低:HBr>HCl>HF
![]() D、CaC2的电子式为
D、CaC2的电子式为
5、用![]() 表示阿伏加德罗常数的数值,下列说法正确的是
表示阿伏加德罗常数的数值,下列说法正确的是
A、在标准状况下,VL水含有的氧原子个数为![]()
B、![]() 的
的![]() 分子所含中子数为
分子所含中子数为![]()
C、1![]() 与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为
与水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为![]()
D、常温时1 L 1![]() 的醋酸溶液中,所含醋酸分子数为
的醋酸溶液中,所含醋酸分子数为![]()
6、下列离子方程式正确的是
A、过量的NaHSO4和Ba(OH)2溶液反应:H+ + SO42- + Ba2+ + OH- == BaSO4↓ +2H2O
B、NH4HCO3和过量NaOH溶液相混合:HCO3- + OH- == CO32- + H2O
C、NaHSO4溶液中滴加NaHCO3溶液:H+ + HCO3- == H2O + CO2↑
D、用氨水吸收少量的SO2:NH3 + H2O + SO2 == NH4+ + HSO3-
7、在含有Cu(NO3)2、Zn(NO3)2 Fe(NO3)3、AgNO3各0.1mol的混合溶液中加入0.1molFe
粉,充分搅拌后铁溶解,溶液中不存在Fe3+离子,同时析出0.1molAg。则下列结论中不
正确的是
A、溶液中Cu2+与Fe2+的物质的量之比为1:2 B、氧化性:Ag+>Cu2+>Fe3+>Zn2+
C、Fe3+的氧化性大于Cu2+ D、1molFe可还原2molFe3+
8、下列叙述正确的是
① 锌跟稀硫酸反应制H2,加入少量硫酸铜溶液能加快反应速率;
② 镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易腐蚀;
③ 电镀时,应把镀件置于电解槽的阴极;
④ 冶炼铝时,把氧化铝加入液态冰晶石中成为熔融体后电解;
⑤ 钢铁表面常易腐蚀生成Fe2O3·nH2O
A、全部 B、①③④⑤ C、①③⑤ D、②④
9、下列物质的提纯或离子检验的方法正确的是
A、用渗析的方法精制氢氧化铁胶体
B、以精铜为阳极,粗铜为阴极,CuSO4溶液为电解液精炼铜
C、除去KCl溶液中的少量MgCl2,加入过量KOH溶液,然后过滤即可
D、加入澄清的石灰水,能产生白色沉淀,则原溶液中一定含有CO![]()
10、在一定温度下,可逆反应:2HI(g)
![]() H2(g)+I2(g),△H>0,已知平衡状态改变某一条件时,混合气体的颜色加深。则下列说法正确的是
H2(g)+I2(g),△H>0,已知平衡状态改变某一条件时,混合气体的颜色加深。则下列说法正确的是
A、改变的条件可能是在恒容条件下,充入HI气体
B、改变的条件可能是在恒压条件下,充入HI气体
C、化学平衡一定向正反应方向移动
D、正反应速率增大,逆反应速度一定减小
11、表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的
A、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C、c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D、c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
12、用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,将碱滴入酸中,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取)
A、碱式滴定管未用待测碱液润洗 B、酸式滴定管未用标准盐酸润洗
C、滴定过程中不慎锥形瓶中有液体溅出 D、滴定前仰视读数,滴定后读数正确
13、 25℃时,水的电离达到平衡:H2O![]() H++OH-;ΔH>0,下列叙述正确的是
H++OH-;ΔH>0,下列叙述正确的是
A、 向水中加入稀氨水,平衡逆向移动,c(OH―)降低
B、 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C、 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D、 将水加热,Kw增大,pH不变
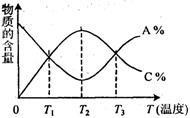 14、 已知可逆反应aA+bB
14、 已知可逆反应aA+bB ![]() cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
cC中,物质的含量A%和C%随温度的变化曲线如图所示,下列说法正确的是
A、 该反应在T1、T3温度时达到过化学平衡
B、 该反应在T2温度时达到化学平衡
C、 升高温度,平衡会向正反应方向移动
D、 该反应的正反应是吸热反应
15、氢氧燃料电池以为还原剂,为氧化剂,电极为多孔镍,电解质溶液为30%的KOH溶液,以下叙述正确的是
①放电一段时间后,电解质溶液中KOH的物质的量将改变
②负极反应为:2H2+4OH——4e— = 4H2O
③工作时正极区pH升高,而负极区pH降低
④工作时阴离子移向正极
A、①③④ B、②③ C、②④ D、①④
16、25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb。下列有关a的说法正确的是
A、a可能等于1 B、a一定大于2
C、a一定小于2 D、a一定等于2
17、中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A、用NaOH和HCl 反应测得的中和热,推算一定量稀H2SO4和NaOH 溶液反应的反
应热
B、用沸点数据推测两种液体混合物用分液方法分离开来的可能性
C、用沸点数据来分析分子的稳定性
D、用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性强弱
18、如图a、b、c、d均为铂电极,供选择的四组电解质溶液如下表:
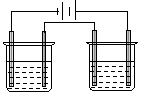 要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降; ②b、c两极放电离子的物质的量相等。则应选用的电解液是
要满足的条件是:①工作一段时间后,甲槽电解液pH上升,而乙槽电解液pH下降; ②b、c两极放电离子的物质的量相等。则应选用的电解液是
|
| 组 |
| B | C | D | ||
| 甲槽 | NaOH | AgN O3 | H2SO4 | KCl | ||
| 乙槽 | CuSO4 | CuCl2 | AgNO3 | AgNO3 |
甲 乙
19、分别在等pH或等物质的量浓度的盐酸和醋酸的等体积溶液中,加入足量镁,H+浓度及![]() 的体积(同温同压下测定)的变化图示如下
的体积(同温同压下测定)的变化图示如下
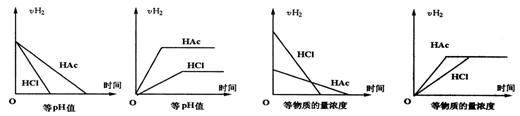
① ② ③ ④
其中正确的是
A、①③ B、②④ C、①②③ D、①②③④
20、甲酸的下列性质中,可以证明它是弱电解质的是
A、1mol/L甲酸溶液的pH值约为2
B、甲酸能与水以任何比例互溶
C、10mL 1mol/L甲酸恰好与10mL 1mol/L NaOH溶液完全反应
D、在相同条件下,甲酸溶液的导电性比强酸溶液的弱
二、实验题:
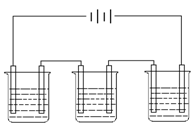 |
21、下图为相互串联的甲、乙两电解池试回答:
(1)若甲池利用电解原理在铁上镀银,则B是
|
应选用的电解质溶液是 。
(2)乙池中若滴入少量酚酞试液,开始电解一段
时间,
|
(3)若甲槽阴极增重4.32g,乙槽中剩余溶液仍为
400mL ,则电解后所得溶液的pH值等于 。
(4)若丙为用石墨电极电解100mLH2SO4和CuSO4混合溶液,通电一段时间后,两极各出现气体2.24L(标准状况),求原来溶液中CuSO4的物质的量浓度为____________。
22、某学生欲测定味精中食盐的含量。
(1)下面是该学生所做的有关实验步骤,请填写所缺的实验步骤②和④。
①称取某牌号的袋装味精样品![]() ,并溶于蒸馏水。
,并溶于蒸馏水。
② 。
③过滤。
④ 。
⑤将沉淀烘干、称量,测得固体质量为![]() 。
。
(2)根据上述实验步骤回答下列有关问题:
①过滤操作所需要的主要仪器有 。
②检验沉淀是否洗净的方法是 。
③烘干沉淀应采取的方法是
A、低温烘干 B、高温烘干 C、利用太阳能烘干
④若味精包装上标注:“谷氨酸钠含量![]() ,
,![]() 含量
含量![]() ,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
,”则此样品是否符合产品标示的质量分数
(填“符合”或“不符合”)。
三、推断题
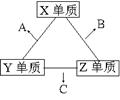 23.X、Y、Z三种短周期元素,它们的原子序数之和为16。
23.X、Y、Z三种短周期元素,它们的原子序数之和为16。
X、Y、Z三种元素的常见单质在常温下都是无色气体,
在适当条件下可发生如右变化:
一个B分子中含有的Z原子个数比C分子中少1个。
请回答下列问题:
(1)X元素在周期表中的位置是第 周期 族。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在 。
(3)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式): 。
(4)已知Y单质与Z单质生成C的反应是可逆反应,![]() H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
A、达到化学平衡时,正反应速率和逆反应速率相等
B、达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
C、达到化学平衡的过程中气体平均相对分子质量减小
D、达到化学平衡后,升高温度,C的体积分数减小
24、A为日常调味品之一,K胶体经过处理可用作干燥剂,F为白色腊状固体,B为无色无
味液体。请回答下列问题:
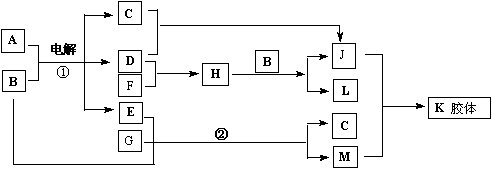 |
(1)写出下列物质化学式:
A:________; D:________;E:________;
(2)判断晶体A、F、G的熔点高低(用化学式表示)________>_________>______
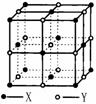 (3)晶体A由两种微粒构成,其晶体结构如图所示,
(3)晶体A由两种微粒构成,其晶体结构如图所示,
相邻最近异种微粒间距为a cm,晶体A的密度为
ρ g/cm3,则用相关数据表达阿伏加德罗常数
NA=__________________。
(4)写出反应②的离子方程式________________。
(5)铁锅与A的溶液接触时容易生锈,可以用方程式表示其原因:
①负极反应:______________正极反应:_______________
② Fe2++2OH—=Fe(OH)2
③__________________________________________________
④ 2Fe(OH)3 + (x-3)H2O==Fe2O3·xH2O(铁锈)
25、 已知:有机物A是一种镇痛解热药品,其结构简式为:
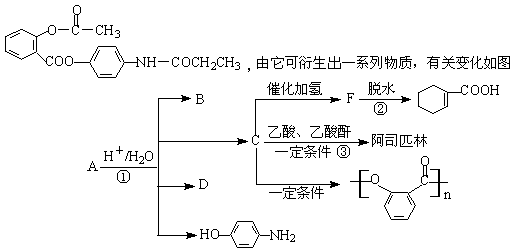 |
(1)B、D的关系是 (填序号)。
a.互为同位素 b.互为同系物 c.互为同分异构体 d.同类物质
(2)写出②③反应的化学方程式,注明反应类型
反应② ; 。
反应③ ; 。
(3)能与FeCl3溶液发生显色反应的属于酯类的C的同分异构体有 种。
四、计算题:
26、某工厂排出的废水中含有金属Ba2+,为了测定其浓度,作如下实验:
①称取K2Cr2O7固体0.1323g溶于适量的稀硫酸中,再向其中加入过量KI,反应后用Na2S2O3 溶液与之反应,当用去27.00mL时恰好完全反应。
②另取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀,沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时 CrO42- 转化为 Cr2O72-,再加过量KI反应,反应液再同上述Na2S2O3 溶液反应,反应完全时,消耗Na2S2O3 溶液24.00mL,已知有关的离子方程式为:
_____Cr2O72-+____I-+______H+=______Cr3++_____I2+____ ______
I2+2S2O32-=2I-+S4O62-
(1)配平上述方程式。
(2)Na2S2O3 溶液的浓度为__________。
(3)求废水中Ba2+的物质的量浓度是多少?
答卷
二、实验题:
21、(1)B极:_________极;材料_______;电极反应:_______________________;_______;
(2)_____________、_____________;(3)_______________;(4)_________________;
22、(1)②___________________________________;④______________________;
(2)①__________________________________;②________________________;
③_____________________;④________________;
三、推断题:
23、(1)________、__________;(2)______________;(3)①______________; _____________;
②________________________________________________________________;
③__________、_____________________________________________________;(4)________;
24、(1)A_________; D_________;E_________;
(2)________>__________>_________;(3)______________;
(4)_________________________________________________________________________
(5)①负极反应___________________________正极反应_____________________________
③________________________________________________________________________
25、(1)_________________;
(2)②_______________________________________________________、_______________;
③_______________________________________________________、_______________
(3)____________;
四、计算题
26、解:
(1)_______Cr2O72-+____I-+______H+=______Cr3++_____I2+____ ______
(2)____________mol/L
(3)
答案
一、选择题:(每小题只有一个选项正确,共2×20=40分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| D | C | B | D | B | C | B | B | A | A |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| B | A | B | B | B | C | C | D | D | A |
二、填空题:
21、(10分)
(1) B: 阳极,Ag Ag—e-=Ag+ AgNO3溶液
(2) 红色 ; 无色
(3) 13 (4) 1mol/L
22、(8分)(1)②加入硝酸酸化的AgNO3;④洗涤沉淀
(2)①漏斗、烧杯、玻璃棒(滤纸);
②在洗液中加入NaCl溶液,不出现白色沉淀
③A
④不符合
![]() 三、推断题:
三、推断题:
23、(12分)(1)二、ⅥA (2)氢键 (3)① 三角锥形
② ③小于,
④A、D
24、(15分)
(1)A:NaCl;D:Cl2;E:NaOH;
(2)Si > NaCl > P4 (3)29.25/(a3×ρ) (4)2OH—+H2O + Si = SiO32—+2H2↑
(5)负极反应:2Fe—4e— = 2Fe2+ 正极反应:O2 + 4e— +2H2O = 4OH—
4Fe(OH)2 +O2+2H2O = 4Fe(OH)3
25、(9分)(1)b
![]() (2)
(2)
②
 消去反应
消去反应
③
酯化反应
(3)3种
四、计算题
26、(6分)解:
(1)__1_Cr2O72-+__6__I-+__14____H+=__2____Cr3++__3___I2+__7__ __H2O____
(2)c(S2O32-) =0.100mol·L-1 (3)c(Ba2+)=0.016mol·L-1
由于题目给出了反应的方程式,可以利用来建立反应的关系式:
2Ba2+----2CrO42----Cr2O72-----2BaCrO4------3I2-------6S2O32-
这里c(S2O32-)需要由 Cr2O72-------3I2-------6S2O32-来确定(①的数据)
1mol 6mol
0.1323g/294g·mol-1 c(S2O32-)×0.027L
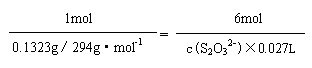 |
(2) c(S2O32-) =0.100mol·L-1
根据:2Ba2+-------------------6S2O32-
2mol 6mol
c(Ba2+)×0.050L 0.100mol·L-1×0.024L
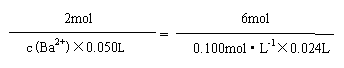
(3) c(Ba2+)=0.016mol·L-1