08届高三化学上册第三次月考试卷
高 三 化 学
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分100分。考试时间90分钟。
第Ⅰ卷(包括21个小题,共42分)
一、选择题(本题包括21小题每小题2分,共42分。每小题只有一个选项符合题意)
1.下列产品的使用不会对环境造成污染的是
A.含磷洗衣粉 B.酒精 C.氟里昂 D.含汞电池
2.据报道,月球上有大量3He存在,以下关于3He的说法正确的是
A.是4He的同分异构体 B.比4He多一个中子
C.是4He的同位素 D.比4He少一个质子
3.下列实验中,仪器的下端必须插入液面下的是
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④将氯化氢气体溶于水时的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计
A ①③④⑤ B ②④⑥ C ①③⑤ D 全部
4.硫酸铵在强热条件下分解:生成NH3、SO2、N2和H2O,该反应中的氧化产物和还原产物的物质的量之比为
A.1∶3 B.2∶3 C.4∶3 D.1∶1
5.设NA为阿佛加德罗常数。下列叙述中正确的是
A.46gNO2和N2O4混合气体中含有原子数为3NA
B.标准状况下22.4LH2中含中子数为2NA
C.1L1mol/L醋酸溶液中离子总数为2NA
D.1 molH2O2完全分解时转移电子2NA个
6.X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
7..用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为Vl和V2,则Vl和V2的关系正确的是
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤ V2
8.类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确最终要经过实践的验证。以下类推的结论正确的是
A. 由甲酸可以发生银镜反应可推出其余的羧酸也均能发生银镜反应
B.NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似
C.由“2Fe+3Cl2=2FeCl3”反应可推出“2Fe+3I2=2FeI3”反应也能发生
D. Na、K具有强还原性,Na常温下与水剧烈反应,故K常温下也能与水剧烈反应
9.下列溶液暴露于空气中,开始一段时间其pH变小的是(不考虑溶质挥发) ①H2S ②H2SO3 ③Na2S ④Ca(OH)2 ⑤氯水 ⑥Na2SO3
A.①②④ B.②⑤⑥
C.①②④⑤ D.②④⑤⑥
10.A和M为两种元素,已知A位于短周期,且A2—与M+的电子数之差为8,则下列说法中正确的是
A.A和M的原子序数之差为8
B.A和M原子的电子总数之和可能是11
C.A和M原子的最外层电子数之和为8
D.A和M原子的最外层电子数之差为7
11.一定能在下列溶液中大量共存的离子组是
A.含有大量Al3+的溶液:Na+、NH4+、SO42—、Cl—
B.c(H+)=1×10—13mol·L—1的溶液:Na+、Ca2+、SO42—、CO32—
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3—、SCN—
D.含有大量NO3—的溶液:H+、Fe2+、SO42—、Cl—
12.下列反应的离子方程式错误的是
A. 碳酸钙跟稀盐酸反应:CO32—+2H+=CO2↑+H2O
B.铁跟氯化铁溶液反应:Fe+2Fe3+=3Fe2+
C.铜跟浓硝酸反应:Cu+2NO3—+4H+=Cu2++ 2NO2↑+2H2O
D.铁跟稀硫酸反应:Fe+2H+=Fe2++H2↑
13.将反应Mn2++BiO3-+H+→MnO4-+Bi3++H2O配平后![]() 的化学计量数为
A、8 B、10 C、14 D、30
的化学计量数为
A、8 B、10 C、14 D、30
14.下列有关说法中,错误的是
A、NH4H是一种离子晶体,其中氢离子的核外电子排布与氦原子相同
B、在石墨晶体中,碳原子与共价键的个数比为2:3
C、三种氢化物的沸点高低:HBr>HCl>HF
![]() D、CaC2的电子式为
D、CaC2的电子式为
15.下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物种类没有影响的是
A.铁和硝酸溶液 B.金属铁与稀盐酸
C.金属钠与氧气 D.单质碳与氧气
16.将钠、镁、铝各0.1mol分别放入足量稀的盐酸中,在同温同压下产生的气体体积比是
A.6׃3׃2 B.1׃2׃3 C.3׃1׃1 D.1׃1׃1
17.在一定温度下,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 单位时间生成n mol的A2同时生成n mol的AB
B. 容器内的总压不随时间变化
C. 单位时间生成2n mol的AB同时生成n mol的B2
D. 单位时间生成n mol的A2同时生成n mol的B2
18.标准状态下,30g下列两金属组成的合金,与足量的盐酸反应放出氢气11.2L,则该合金可能是
A、钾与钠 B、锌与铜 C、钠与镁 D、铁与铝
19.关于某无色溶液中所含离子的鉴别,下列判断正确的是
A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有Cl-存在
B.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有大量CO32-
20. 已知A、B、C、D、E是核电荷数依次增大的五种短周期元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是
A.A、B、E一定在不同周期 B.D为第二周期
C.A、D可能在同一主族 D.C、D的单质可能化合为离子化合物
21.某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则组成该单质的元素在产物中的化合价可能是
A.+1 B.+2 C.+4 D.+2或+4
第Ⅱ卷(非选择题 共58分)
选择题答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | |
| 答案 |
22.(14分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
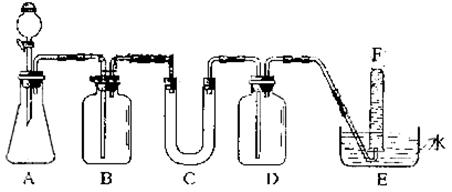
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | ||
| D | 氢氧化钠溶液 |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________________________。
(4)试管F中收集满气体后,下一步实验操作是:
。
23.(17分)A、B、C、D、E是相邻三个周期中的五种元素,它们的原子序数依次增大,B、C、D属同一周期,A、E在周期表中处于同一纵行.已知:①除A外,各元素原子的内层均已填满电子,其中B的最外层有4个电子;②A与B,B与C都能生成气态非极性分子的化合物;③D与E生成离子化合物,其离子的电子层结构相同.回答:
(1)A为________元素(填名称,下同),B为________元素,
C为________元素,D为________元素,E为________元素;
(2)C元素在周期表中属第________周期,________族元素;
(3)D与B形成的化合物的电子式________,属________晶体;
(4)C与E形成的化合物的电子式为____________和____________,属______晶体.
24.(15分)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1) 若反应进行到某时刻![]() 时,
时,![]() (N2)=13 mol,
(N2)=13 mol, ![]() (NH3)=6 mol,计算a的值。
(NH3)=6 mol,计算a的值。
(2) 反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
(3) 原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),
![]() (始):
(始):![]() (平)=________________。
(平)=________________。
(4) 原混合气体中,![]() :
:![]() =___________。
=___________。
(5) 达到平衡时,N2和H2的转化率之比,![]() (N2):
(N2):![]() (H2)_______。
(H2)_______。
(6) 平衡混合气体中,![]() (N2):
(N2):![]() (H2):
(H2):![]() (NH3)_____________。
(NH3)_____________。
25.(12分)不同卤素原子间可以通过共用电子对,形成卤素互化物,其通式为:XX′n(n = 1,3,5,7;且非金属性X′>X)。卤素互化物的结构性质与卤素单质相似。回答下列问题:
⑴在IBr中碘元素的化合价是 ,IBr应属于 晶体。IBr与氢氧化钠溶液反应的离子方程式是 。
⑵在所有卤素互化物中,沸点最低的应是 (写分子式,下同)。
⑶若n = 7,则最可能生成的卤素互化物应为 。
⑷某卤素互化物与水的反应为 ClFn + H2O → HClO3 + Cl2 +O2 + HF,若ClFn与H2O的物质的量之比为3∶5,则n= 。
高三第三次月考化学标准答案
一.选择题(每题4分)
1.B 2.C 3.C 4.A 5.A 6.C 7.A 8.D 9.D 10.B 11.A 12.A 13.C 14.C 15.B 16.B 17C 18A 19.C 20.B 21.D
22.(1)CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 除去CO2气体中氯化氢 | |
| C | 过氧化钠 | 与CO2和H2O反应生成氧气 |
| D | 吸收氧氧气中二氧化碳 |
(3) 2Na2O2+2CO2=2Na2CO3+O2
(4)把E中的导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气。
23.(12分)每线1分 (1)氢,碳,氧,氟,钠; (2)二,ⅥA;
(3)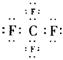 ,分子 (4)
,分子 (4)![]() , 离子
, 离子
24.(12分)每线2分(1)![]() =13+3=16。
=13+3=16。
(2)![]() 平(NH3)=
平(NH3)=![]() ×25%=32 mol×25%=8 mol
×25%=32 mol×25%=8 mol
(3)5:4 (4)2:3 (5)1:2 (6)3:3:2
25.(1)+1 分子IBr +2OH-=Br-+ IO-+H2O (2)ClF (3)IF7 (4) 3