08届高三化学上册第二次月考化学试卷
考试时间120分钟 满分100分 出卷:郑静
(原子量Na—23 S---32 H—1 O—16 K---39 Cl---35.5)
一.选择题(每题只有一个正确答案,每题2分,共25题,计50分)
1、对危险化学品要在包装标签上印有警示性标志。氢氧化钠溶液应选用的
标志是( )




A.爆炸品 B 氧化剂 C 剧毒品 D腐蚀品
2.下列混合物的分离和提纯方法中,主要不是从物质的溶解性角度考虑的是( )
A.过滤 B.蒸馏 C.结晶 D.萃取
3. 同温同压下,当反应物分解了8%时,总体积也增加8%的是( )
![]()
![]() A.2NH3(g) N2(g)+3H2(g)
B.2NO(g) N2(g)+O2(g)
A.2NH3(g) N2(g)+3H2(g)
B.2NO(g) N2(g)+O2(g)
![]()
![]() C.2NO3(g) 4NO2(g)+O2(g) D.2NO2(g)
2NO(g)+O2(g)
C.2NO3(g) 4NO2(g)+O2(g) D.2NO2(g)
2NO(g)+O2(g)
4、下列各种说法中,都包含有前后两个数值,其中前者大于后者的是( )
A. 在25℃和80℃时纯水中的c(H +)
B. 室温时,浓度均为 0.1 mol·L-1 的 (NH4)2SO4(aq) 、(NH4)2CO3 (aq)的 c (NH4+)
C. 相同条件下,0.l mol·L-1 NaHCO3 和 0.1 mol·L-1 Na2CO3 溶液的 pH
D. 1 L饱和氯化铵溶液中NH4+ 和Cl- 的个数
5. 为了除去MgCl2酸性溶液中的Fe3+,可以在加热的条件下加入一种试剂,过滤后再加入适量盐酸,这种试剂是 ( )
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
6. 室温下,Va LpH=a的强酸与Vb LpH=b的强碱溶液混合,混合后溶液pH=3。已知a+b=13,Vb=4.5Va ,则a值为 ( )
A.2 B.3 C.4 D.5
7. 咖喱是一种烹任辅料,若白衬衣被咖喱汁玷污后,用普通肥皂洗涤该污渍时会发现,黄色污渍变为红色。经水漂洗后红色又变为黄色。据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用 ( )
A 品红溶液 B 石蕊溶液 C 氯水 D KI一淀粉溶液
8.在密闭容器中,在一定条件下,进行下列反应:
NO(g) + CO(g) ![]() 1/2N2(g)
+ CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)
+ CO2(g);△H = -373.2 KJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
9. 常温下设a代表Ba(OH)2,b代表NaOH溶液,c代表NH3·H2O溶液。下列说法正确的是
A、同物质的量浓度的三种溶液的pH:a>b>c
B、同pH时,三种溶液稀释相同倍数后,pH:a>b>c
C、同pH、同体积的三种溶液消耗同浓度盐酸 的体积:a=b=c
D、同pH时,稀释不同倍数、pH仍相同,三种溶液稀释的倍数:a>b>c
10. 若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+ Na+ NO3- Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ Fe2+ SO42- NO3
11.用已知浓度的盐酸测定未知浓度的NaOH溶液的物质的量浓度,进行酸碱中和滴定时,无论是酸往碱中滴还是碱往酸中滴,下列操作都会使测定结果偏低的是(锥形瓶中溶液用滴定管量取) ( )
A.碱式滴定管未用待测碱液润洗 B.酸式滴定管未用标准盐酸润洗
C.滴定过程中不慎有液体溅出 D.滴定前仰视读数,滴定后读数正确
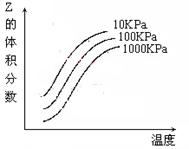 12.右图是温度和压强对X + Y
12.右图是温度和压强对X + Y ![]() 2Z 反应影响的示意图。图横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z 反应影响的示意图。图横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的△H>0
13.某学生用量筒量取液体,将量筒平放且面对刻度平视测量。初次视线与量筒内凹液面的最低处保持水平,读数为20毫升。倒出部分液体后,俯视凹液面的最低处,读数为5毫升,则该学生实际倒出液体的体积( )
A 大于15毫升 B 小于15毫升 C 等于15毫升 D 无法确定
14. 某温度下在密闭容器中发生如下反应:
![]()
![]() 2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为
2E(g) 若开始时只充入2mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M和1mol N 的混合气体达平衡时M的转化率为
A.20% B.40% C.60% D.80%
15、欲配制100ml 1.0 mol/LNa2SO4溶液,正确的方法是
① 将14.2 g Na2SO4 溶于100ml水中
② 将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③ 将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A、①② B、②③ C、①③ D、①②③
16.在恒温恒压下,将3molA和1molB放入一密闭容器中发生反应:2A(g)+B(g)![]() 2C(g),达到化学平衡(Ⅰ)。在同样条件下,3molA和2molB发生同样的反应,达到化学平衡(Ⅱ)。现将平衡(Ⅱ)的混合气全部压入平衡(Ⅰ)的容器中,在同样条件下达到化学平衡(Ⅲ)。下面关于平衡(Ⅰ)、(Ⅱ)、(Ⅲ)的说法错误的是:( )
2C(g),达到化学平衡(Ⅰ)。在同样条件下,3molA和2molB发生同样的反应,达到化学平衡(Ⅱ)。现将平衡(Ⅱ)的混合气全部压入平衡(Ⅰ)的容器中,在同样条件下达到化学平衡(Ⅲ)。下面关于平衡(Ⅰ)、(Ⅱ)、(Ⅲ)的说法错误的是:( )
A.平衡(Ⅲ)中A的转化率等于B的转化率
B.平衡(Ⅰ)中A的转化率小于B的转化率
C.n(C)/n(A)的比值,平衡(Ⅲ)中比平衡(Ⅰ)中小
D.n(A)/n(B)的比值,平衡(Ⅲ)中比平衡(Ⅱ)中大
17.20℃时,KCl的溶解度为34g,若忽略固体溶解引起的溶液体积变化,则在该温度下,所配KCl溶液的物质的量浓度不可能是( )
A.5mol/L B.4mol/L C.3mol/L D.2mol/L
18. 在相同温度下等体积、等物质的量浓度的4种稀溶液:①Na2SO4 ②H2SO3 ③NaHSO3④Na2S,所含带电微粒的数目由多到少的顺序是( )
A.①=④>③=② B.①=④>③>② C.①>④>③>② D.④>①>③>②
19.下列物质的水溶液,能在蒸发皿中加热浓缩得到原物质的是( )
①NaAlO2,②FeCl3,③明矾,④绿矾,⑤KNO3,⑥H2S,⑦HCI,⑧蛋白质,⑨Na2SO3,⑩CaCl2。
(A)①③⑤⑥⑧⑩ (B)②③④⑤⑨⑩ (C)③⑤⑦⑩ (D)①③⑤⑩
20. 某温度下,在一容积可变的容器中,反应2A(g)+B(g)![]() 2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
2C(g)达到平衡时,A、B和C的物质的量分别为4mol、2mol和4mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍 C.均增加1mol D.均减少1mol
21、下列溶液①pH=0的盐酸,②0.5 mol/L HCl溶液,③0.1 mol/L的NH4Cl溶液,④0.1 mol/L的NaOH,⑤0.5 mol/L CH3COONa溶液,这五种溶液中由水本身电离的c(H+)由大到小的顺序正确的是 ( )
A.①②③④⑤ B.⑤③④②① C.①②③⑤④ D.⑤③④①②
22. 下列离子方程式中书写正确的是 ( )
A. 向NaOH(aq)中通入过量H2S气体:H2S + 2 OH-== S2— + 2 H2O
B. FeCl3水解:FeCl3 + 3 H2O = Fe(OH)3↓+ 3 H+
C. 碳酸氢钠溶液和醋酸反应:HCO3- + CH3COOH == CH3COO— + H2O + CO2↑
D. 氨水中加入明矾溶液 3 OH- + Al3+ === Al(OH)3↓
23. 一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g)![]() 2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是( )
A. 保持温度和容器体积不变,充入1molSO3(g)
B. 保持温度和容器内压强不变,充入1molSO3(g)
 C. 保持温度和容器内压强不变,充入1molO2(g)
C. 保持温度和容器内压强不变,充入1molO2(g)
D. 保持温度和容器内压强不变,充入1molAr(g)
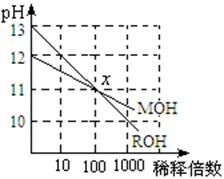
24.MOH和ROH两种一元碱的溶液分别加水稀释时,
pH变化如右图所示。下列叙述中不正确的是 ( )
A.MOH是一种弱碱
B.在x点,c(M+) = c(R+)
C.在x点,ROH完全电离
D.稀释前,c(ROH) =10 c(MOH)
25. 已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中一定正确的是 ( )
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
二.填空题(共23分)
26、(6分)混合物分离的方法在生产、生活和科学实验中有着广泛的应用。请指出下列做法中分别应用了哪些分离方法?
a、熬煮中药 b、分离豆浆和豆渣
c、除去水中的沙子 d、用海水晒盐
e、海水淡化 f、从溴水中提取溴
27、(8分).A、B两种物质都 是由H、N、O、Na中的任意三种元素组成 的强电解质,A的水溶液呈碱性,B的水溶液呈酸性,请找出A、B可能的两种组合,要求A1的溶液中水的电离程度小于A2溶液中水的电离程度,B1溶液中水的电离程度小于B2溶液中水的电离程度。
(1)写出化学式A1________ B2_______
(2)相同温度下,当A1、B1的物质的量浓度相等时,两溶液中水电离出的H+的物质的量浓度之比为_____________
(3)若B1、B2两溶液的pH = 5,则两溶液中水电离的H+的物质的量浓度之比为______
28 . (9分)①在6份0.01 moL/L氨水中分别加入下列各物质:A.浓氨水,B.纯水,C.少量K2SO3固体,D.少量浓硫酸,E.少量NaOH固体,F.少量Al2(SO4)3,固体。
(a)能使C(OH-)减小,使C(NH![]() )增大的是____________;(b)能使C(OH-)增大,使C(NH
)增大的是____________;(b)能使C(OH-)增大,使C(NH![]() )减小的是________;(c)能使C(0H-)和C(NH
)减小的是________;(c)能使C(0H-)和C(NH![]() )都增大的是_________;(d)能使C(OH-)和C(NH
)都增大的是_________;(d)能使C(OH-)和C(NH![]() )都减小的是______________。(均写编号)
)都减小的是______________。(均写编号)
②25℃时用Pt电极电解500mL amol/L CuSO4溶液,
试回答下列有关问题:
(a)写出两极的电极反应式:阳极____________,阴极__________。
(b)当电解到C(Cu2+)为0.5a mol/L时,停止电解,若要使溶液恢复到与电解前相同的状态,可向溶液中加入适量的( )
(A)CuSO4粉末 (B)CuSO4·5H2O
(C)CuO粉末 (D)Cu(OH)2
三.实验题(共15分)
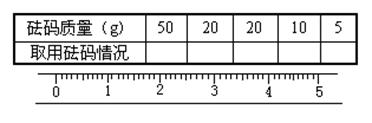
29. (3分)在称量小烧杯时,用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码,若小烧杯的质量为32.6g,请用箭头在下表中填空,表示添加砝码的过程,并在标尺上画出游码(用“█”表示)的位置。
30. (12分)下图中的几种仪器装置都可以制得氢气,其中:
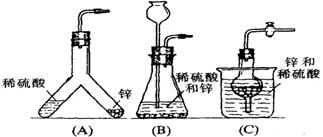
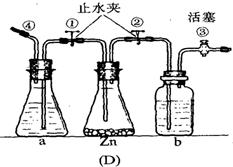
(1)能使发生或停止发生氢气操作均比较方便的装置是(写编号) ,能够灌充升空的小氢气球的装置是(写编号) 。
(2)在(D)装置中a中的液体应是 ;b中的液体应是 ,其作用是 。
(3)使(D)装置发生氢气的操作顺序应该是 。
四.计算题(12分)
![]() 31. 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
31. 恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:
N2 (g) + 3 H2(g) 2NH3(g)
⑴若反应达平衡时某时刻t时,nt (N2) = 13mol,nt (NH3) = 6mol,计算a的值
⑵反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。计算平衡时NH3的物质的量。
⑶原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
⑷原混合气体中,a∶b = 。
⑸达到平衡时,N2和H2的转化率之比,α(N2)∶α (H2)= 。
⑹平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。