08届高三化学上册第二次能力测试
化学部分
相对原子质量:H——1 C——12 O——16 Na——23
6.据报道,法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称
为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性 B.该粒子质量比氢原子大
C.该粒子质量数为4 D.在周期表中与氢元素占同一位置
7.若![]() 表示阿伏加德罗常数的值,下列叙述正确的是( )
表示阿伏加德罗常数的值,下列叙述正确的是( )
A.0.84
g![]() 晶体中阳离子和阴离子总数为0.03
晶体中阳离子和阴离子总数为0.03![]()
B.a
g![]() 和
和![]() 的混合气体中所含分子数一定为
的混合气体中所含分子数一定为![]()
C.1.8
g ![]() 含有的质子数为
含有的质子数为![]()
D.标准状况下,2.24
L四氯化碳含碳原子数为0.1![]()
8.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于浓度不同而能发生不同氧化还原反应的( )
A.①③ B.③④ C.①② D.①③④
9.下列离子方程式书写正确的是 ( )
A.铁跟盐酸反应:2Fe+6H+ 2Fe3++3H2↑
B.碳酸氢钙溶液跟过量氢氧化钠溶液反应:Ca2++HCO3-+OH- CaCO3↓+H2O
C.次氯酸钙溶液中通入过量的CO2;ClO-+H2O+CO2 HCO3-+HClO
D.氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O AlO2-+4NH4++2H2O
10.用相同质量的金属钠进行下列实验,产生氢气最多的是( )
A.将钠投入到足量的盐酸中 B.将钠投入到足量的乙醇中
C.将钠用铝箔包好,并刺有小孔,投入足量的水中
D.将钠投入足量硫酸铜溶液中
11.在下列比较中,正确的是 ( )
A.受热稳定性:HI>HBr>HCl>HF B.碱性:NaOH>Al(OH3)>Mg(OH)2
C.微粒半径:F—<Na+<Mg2+ D.单质的熔点:Li >Na>K>Rb
12.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了
②用滴定管量取液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水 ⑤定容时,仰视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
A.①③⑤⑥ B.①②⑤⑥ C.②③④⑥ D.③④⑤⑥
13.已知:2H2(g)+O2(g)=2H2O(l):△H=-571.6kJ/mol
H2(g)+![]() O2(g)=H2O(g);△H=-241.8kJ/mol
O2(g)=H2O(g);△H=-241.8kJ/mol
则氢气的燃烧热为( )
A.241.8kJ/mol B.-241.8kJ/mol
C.285.8kJ/mol D.571.6kJ/mol
26.(18分)请填写下列空白:
(1)现用物质的量的浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度;
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是______________。
②下图2是酸式滴定管中液面在滴定前后的读数:
 | |||||
| |||||
c (NaOH) = _______________________________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测定的NaOH物质的量浓度会偏_______ ____。
(2)图3是中学化学实验中的一种常用装置,若要在仅盛有少量水的水槽的条件下
检查其气密性(不得使用任何导管、橡皮管,且不得拔下橡皮塞等),其操作方
法和现象是 。
| |
②除去KCl溶液中的SO![]() ,依次加入的试剂为(填溶质的化学式) 。
,依次加入的试剂为(填溶质的化学式) 。
27.(12)在一定条件下,下列各物质可发生如图所示的变化(反应中生成的水没有写出)
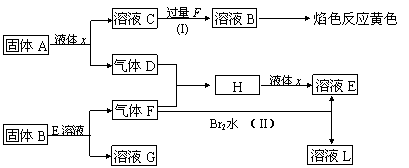 |
请回答:(1)固体A是(写化学式) 。
(2)反应(I)的化学方程式 。
(3)反应(II)的化学方程式 。
28.(18分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性,U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为 ;XW的电子式为 ;Z元素在周期表中的位置是 。
(2)U元素形成的同素异形体的晶体类型可能是(填序号) 。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式) ;U、W的氢化物分子结合H+能力较强的是(写化学式) ,用一个离子方程式加以证
明 。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW有关反应的离子方程式为 。
由此可知VW和YW2还原性较强的是(写化学式) 。
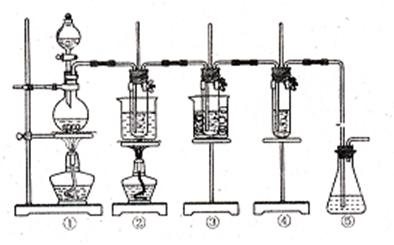
|
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH溶液,并置于水浴中;③的试管里盛有15mL8%NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。 请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水
C.浓硫酸 D.饱和碳酸氢钠溶液
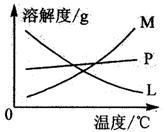
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
反应完毕生经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解曲线的是 (填写编号字母);从②的试管中分离出该晶体的方法是
(填写实验操作名称)
|
(3)本实验中制取次氯酸钠的离子方程式是 。
(4)实验中可观察到④的试管里的溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
| 然后溶液从无色逐渐变为 色 |
|