08届高三化学上册第四次月考试题
学号 班级 姓名
分值:108分 时量:90分钟
相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27 S-32 Cl-35.5Fe-56
一、单项选择题(本题包括16小题,每小题3分,共48分。每小题只有一个选项符合题意)
1.韩国首尔大学科学家将水置于一个足够强的电场中,在20℃时,水分子瞬间凝固形成了“暖冰”。下列关于“暖冰”的说法不正确的是
A.“暖冰”也是水分子间通过氢键结合而成的固体
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.形成20℃时的“暖冰”的变化是物理变化
D.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
2.不具有放射性的同位素称之为稳定同位素,近20年来,稳定同位素分析法在植物生理学、生态学和环境科学研究中获得广泛应用。如在陆地生态系统研究中,2H、13C、15N、18O、34S等常用做环境分析指示物。下列说法中正确的是
A.34S原子核内的中子数为16 B.13C和15N原子核内的质子数相差2
C.1H216O在相同条件下比1H218O更易蒸发
 D.2H+的酸性比1H+的酸性更强
D.2H+的酸性比1H+的酸性更强
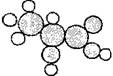
3.下图是一种有机物的比例模型。该模型代表的有机物可能是
A.羟基羧酸 B.饱和一元醇
C.羧酸酯 D.饱和一元醛
4.下列实验方法不能达到目的的是
A.用分液法分离水和乙酸乙酯的混合物
B.用四氯化碳萃取溶解在水的碘
C.用盐析法分离油脂皂化反应的产物
D.在氯化铁溶液中滴加氢氧化钠溶液并不断振荡以制备氢氧化铁胶体
5.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是
A.C(s)+H2O(g)=CO(g)+H2(g);ΔH>0
B.Ba(OH)2·8H2O+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(l)+8H2O(l);ΔH>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g);ΔH<0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH<0
6.目前人类已发现的非金属元素除稀有气体外,共有16种,下列对这16种非金属元素的相关判断:
①都是主族元素,最外层电子数都大于4
②单质在反应中都只能作氧化剂
③氢化物常温下都是气态,所以又都叫气态氢化物
④氧化物常温下都可以与水反应生成酸
A.只有②③正确 B.只有①③正确
C.只有④正确 D.①②③④均不正确
7.纯净的氯化钠是不潮解的,但粗盐很容易潮解,这主要是因为其中含有杂质MgCl2的缘故。为得到纯净的氯化钠,有人设计了一个实验:把买来的粗盐放入纯氯化钠饱和溶液一段时间,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中,正确的是
A.粗盐的晶粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中NaCl饱和溶液浓度会变大(温度不变)
8.已知乙烯和乙炔燃烧的热化学方程式分别为:
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l);ΔH= -2600 kJ·mol―1
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l);ΔH= -1411 kJ·mol―1
又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
9.下列物质中,既有离子键,又有共价键,且是非极性共价键的是 ( )
A.H2SO4 B.Na2O2 C.CaCO3 D.NH4Cl
10.NA为阿伏加德罗常数,下列叙述不正确的是 ( )
①1 mol甲基含有10 NA个电子
②a mol Cl2与足量烧碱溶液完全反应转移的电子数为2a NA
③1 mol O2在反应中作氧化剂时,所得电子数一定为4NA
④1 mol FeCl3完全转化成Fe(OH)3胶体,便有NA个Fe(OH)3胶粒
⑤一定条件下,1 mol N2与足量H2反应,可生成2 NA个NH3分子
A.②④ B.①③⑤ C.①②④ D.①②③④⑤
11.下列离子方程式书写正确的是 ( )
A.鸡蛋壳在醋酸溶液中溶解有气泡产生:CaCO3+2H+=Ca2++H2O+CO2↑
B.用电石与饱和食盐水反应制取乙炔:CaC2+2H2O Ca2++2OH—+C2H2↑
C.偏铝酸钠溶液中加入少量盐酸:H++AlO2—+H2O Al(OH)3↓
D.氯气与水反应:Cl2+H2O 2H++Cl—+ClO—
12.在给定的四种溶液中,以下各组离子可能大量共存的是 ( )
A.滴加石蕊试液显红色的溶液:K+、Ag+、NO3—、F—
B.pH值为3的溶液:Al3+、Na+、SO42—、Br—
C.水电离出来的c(H+)=10—13mol/L的溶液:Na+、Mg2+、NO3—、ClO—
D.所含溶质的NaNO3的溶液:H+、Fe2+、Cl—、SO42—
13.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32—)、c(HCO3—)都减少,其方法是( )
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
14.两种电解装置:①以铜为电极对Na2SO4溶液进行电解 ②以铂为电极对Na2SO4溶液进行电解当两装置中产生的氢气质量相同,两装置消耗的水的质量之比为 ( )
A.1:1 B.2:1
C.1:2 D.有一装置不消耗水,无法比较
15.下列电极反应中,既可能是原电池中的电极反应,又可能是电解槽中的电极反应的是
( )
A.2H++2e— H2↑ B.H2-2e—=2H+
C.O2+4e—+2H2O=4OH— D.4OH—-4e—=O2↑+2H2O
16.某烃的衍生物含碳40%,该有机物的相对分子质量必定是下列数值中某一数值的n倍(n倍为正整数),该数值是 ( )
A.20 B.30 C.40 D.50
二、非选择题(共60分)
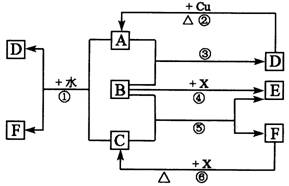
17.(16分)下列各物质为中学化学中常见物质,其中A、C、E、F为气体,B、D为无色液体,D是一种重要的化工原料,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
 |
试回答下列问题:
(1)根据图中信息,B、C、D、X氧化性从强到弱的顺序是_________。(用对应物质的化学式表示)
(2)B的电子式为:_________________________。
(3)写出反应②的化学方程式:______________________。
(4)写出反应①、⑥的离子方程式:
①__________________________________________________;
⑥__________________________________________________。
18.(16分)已知物质A显酸性,F为七原子组成的环状物,请根据以下框图回答问题:
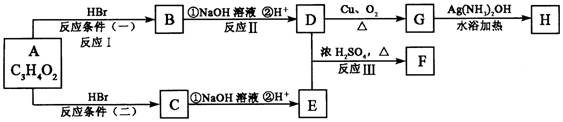
(1)写出下列物质的结构简式:A:__________________,G:__________________。
(2)反应Ⅰ、Ⅱ、Ⅲ的反应类型分别为__________、_________、_________。
(3)写出D和E反应生成F的化学方程式:_______________________。
(4)写出C的同分异构体中属于酯类物质的结构简式:(任写两种)________、________。
19.(18分)下图是一个制取氯气并以氯气为原料进行特定反应的装置,请回答下列问题。
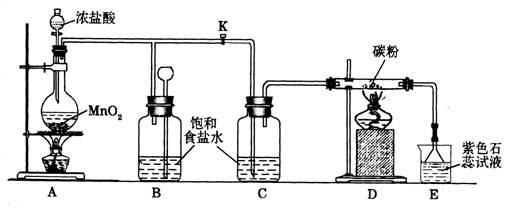 |
(1)A是氯气发生装置,其中发生的反应的化学方程式为________________。
(2)实验开始时,先点燃装置A处的酒精灯,打开弹簧夹K,让Cl2充满整个装置,再点装置D处的酒精灯,Cl2通过C瓶后再进入D(D装置的硬质玻璃管内盛有碳粉)发生氧化还原反应,其产物为CO2和HCl。D中发生反应的化学方程式为_____________________,装置C的作用是______________________。
(3)实验过程中,E处产生的现象为___________________________。
(4)D处反应完毕后,关闭弹簧夹K,移去酒精灯,由于余热的作用,A处仍有Cl2产生,此时B中出现的现象是________________________,装置B的作用是________________。
(5)若实验中使12 mol · L – 1的浓盐酸10 mL与足量的MnO2反应,则生成的Cl2的物质的量总是小于0.03 mol,其原因是__________________________。
(6)若要吸收从硬质玻璃管中导出的气体,E中应盛放__________溶液,其中有毒气体与之反应的离子方程式是_________________________。
20.(10分)现有甲、乙两个容积相等的恒容密闭容器,向甲中通入6
mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 mol C,将两容器的温度恒定为770 K,使反应3A (g) + B (g)![]() xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
请回答下列问题:
(1)若平衡时,甲、乙两容器中A的物质的量相等,则x = ______;若平衡时,甲、乙两容器中A的物质的量不相等,则x = ______。
(2)平衡时,甲、乙两容器中A、B的物质的量之比是否相等?_______(填“相等”或“不相等”),平衡时甲中A的体积分数为_______。
(3)若平衡时两容器中的压强不相等,则两容器中压强之比为________。
参考答案
一、选择题(本题包括16小题,每小题3分,共48分。)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| B | C | A | D | D | D | C | A |
| 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| B | D | A | C | C | D | D | C |
17.答案:(共16分)
(1)MnO2 > Cl2 > H2O2 > H2SO4 (4分)
|
(3)Cu + 2H2SO4 (浓) CuSO4 + SO2↑+
2H2O (2分)
|
MnO2 + 4H+ +
2Cl – Mn2+ + Cl2↑+
2H2O (2分)
18.答案:(共16分,每空2分)
(1)CH2 CH—COOH 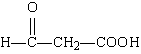
(2)加成反应、取代反应(或水解反应)、酯化反应
(3)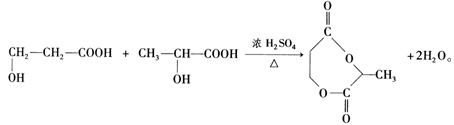
(4)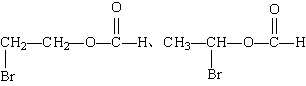
19答案:(共18分,每空2分)
|
(2)2Cl2 + 2H2O
(g) + C 4HCl + CO2
吸收氯气中的HCl,提供D处反应所需的水蒸气
(3)E中溶液先变红后褪色
(4)瓶中液面下降,长颈漏斗中液面上升 贮存少量多余的Cl2
(5)随着反应的进行,盐酸的浓度不断减小,减小到一定程度时将不再进行反应
(6)强碱 Cl2 + 2OH – Cl – + ClO – + H2O
20.答案:(共10分,每空2分)
(1)x = 4 x
= 4 (2)相等 0.6 (3)![]()