08届高三化学上册第四次模拟考试试题
可能用到的相对原子质量: H 1 C 12 N 14 O 16 Na 23 S 32 Cu 64
第Ⅰ卷 (选择题,共70分)
一、选择题(本题包括10小题,每小题3分。共计30分。每小题只有一个选项符合题意。)
1.下列物质与相应现象不相关的是( )
A. SO2:酸雨 B. CO2:温室效应
C. 氯气:富营养污染 D. 氟氯烃:臭氧层空洞
2.下列物质的俗名错误的是( )
A. Ca(OH)2:生石灰 B. HCHO:蚁醛 C. C6H5OH:石炭酸 D. Na2CO3:纯碱
3.以下化学用语正确的是( )
A. 乙炔的最简式:CH≡CH B. 乙酸乙酯的分子式:C4H8O2
C. CO2的电子式:![]() D. S2—的最外层电子排布式:3s23p4
D. S2—的最外层电子排布式:3s23p4
4.以NA表示阿伏加德罗常数,下列判断错误的是( )
A. NA个质子的质量约为1 g B. 32 g S2和S4的混合物含有NA个S原子
C. 0.5 mol Na2O2含有NA个阴离子 D. 标准状况下, 1 mol己烷含有NA个分子
5.以下“新闻”肯定是伪科学的是( )
A. 发现了铁元素+8价的化合物 B. 制得了能溶解任何物质的溶剂
C. 发现微量的NO有益健康 D. 找到了常温常压下合成氨的催化剂
6.具有相同电子层数的X、Y、Z三种元素,已知它们最高价氧化物的水化物的酸性强弱顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
A. 原子半径:X>Y>Z B. 元素的非金属性:X>Y>Z
C. 气态氢化物的稳定性:HX<H2Y<ZH3 D. 阴离子的还原性:X->Y2->Z3-
7.利用下列各组物质制备和收集气体,能采用右图装置的是( )
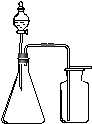 A. 浓氨水与生石灰反应制NH3
A. 浓氨水与生石灰反应制NH3
B. 浓盐酸与二氧化锰反应制Cl2
C. 过氧化氢溶液与二氧化锰反应制O2
D. 电石与饱和食盐水反应制C2H2
8.有关晶体的下列说法中正确的是( )
A. 晶体中分子间作用力越大,分子越稳定 B. 原子晶体中共价键越强,熔点越高
C. 干冰融化时分子中共价键发生断裂 D. 氯化钠溶于水时离子键未被破坏
9.以下物质的制备原理错误的是( )
A. 无水氯化镁的制备 :MgCl2·6H2O![]() MgCl2+ 6H2O
MgCl2+ 6H2O
B. 钴的制备:3Co3O4+8Al![]() 9Co+4Al2O3
9Co+4Al2O3
C. 烧碱的制备:2NaCl+2H2O![]() 2NaOH +H2↑+ Cl2↑
2NaOH +H2↑+ Cl2↑
D. 漂粉精的制备: 2Ca(OH)2+ 2Cl2→Ca(ClO)2 +CaCl2+2H2O
10.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化合物的化学式可以表示为( )
A. B3A2 B. BA2 C. A3B2 D. AB2
二、选择题(本题包括10小题.每小题4分。共计40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。)
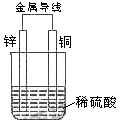 11.关于如图所示装置的叙述,正确的是( )
11.关于如图所示装置的叙述,正确的是( )
A. 铜是阳极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 氢离子在铜片表面被还原
12 以下决定物质性质的因素全面、正确的是( )
A. 元素的化学性质:元素原子的最外层电子数 B. KNO3的溶解度:温度
C. 分子间作用力:相对分子质量 D. 气体摩尔体积:温度、压强
13 氢化亚铜(CuH)是一难溶物质,用CuSO4溶液和“另一种反应物”在40℃~50℃时反应可生成它。CuH不稳定,易分解;CuH在氯气中能燃烧;跟盐酸反应能产生气体,以下有关它的推断中错误的是 ( )
A.“另一种反应物”一定具有氧化性 B.CuH既可做氧化剂也可做还原剂
C.CuH+Cl2==CuCl+HCl↑(燃烧) D.CuH+HCl====CuCl+H2↑(常温)
14.下列实验用错试剂的是( )
A. 用水萃取乙酸乙酯中的乙酸 B. 用碱石灰吸收氨气中的水蒸气
C. 用热碱溶液除去待镀铁件表面的油污 D. 用稀硝酸清洗试管内壁附着的银
15.常温下,测得某氨水溶液的pH 约为12,将其与0.01 mol/L的盐酸等体积混合后,所得溶液中物质的量浓度最大的离子是( )
A. Cl- B. NH4+ C. H+ D. OH-
16.根据有关化学原理,下列判断正确的是( )
A. 常温下,弱酸A的浓度小于弱酸B,则A的电离度一定大于B
B. 晶体A易溶于CCl4,则A一定是分子晶体
C. 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属
D. 能量低的状态更稳定,则自然界的物质都以能量最低的形态存在
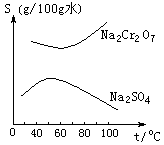 17.根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。
17.根据右图所示的溶解度表,要从混有Na2SO4的Na2Cr2O7晶体中得到Na2Cr2O7,需要进行三个操作。
这三个操作不包括( )
A. 升温结晶 B. 趁热过滤
C. 降温结晶 D. 蒸发结晶
18.可逆反应A(g)+ B(s) ![]() 2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
2C(g)+Q(Q>0)进行至t时刻,发现C的百分含量仍在增大,此时要增大正反应的速率,可采取的措施是( )
A. 增大B物质的量 B. 升温 C. 减压 D. 使用适宜催化剂
19.下列离子方程式正确的是( )
A. 氢氧化钡溶液中滴加稀硫酸:Ba2++OH-+ H++SO42- →BaSO4↓+H2O
B. 饱和碳酸钠溶液通入二氧化碳后溶液浑浊:2Na++CO32-+CO2+H2O → 2 NaHCO3↓
C. 少量SO2用氨水吸收:2NH3·H2O + SO2 → 2NH4+ + SO32- +H2O
D. 往明矾溶液中加入氢氧化钡溶液至Al3+完全沉淀:
Al3+ + 2 SO42— + 2 Ba2+ + 3OH — → Al(OH)3↓+ 2BaSO4↓
20.在溶有Fe2(SO4)3和CuSO4的溶液中加入锌粉, 下列说法中不正确的是 ( )
A.若锌粉有剩余, 则不溶物中一定有铜,可能有铁
B.若锌粉有剩余, 则溶液中的金属阳离子只有Zn2+
C.若锌粉无剩余, 且溶液中尚存有Cu2+, 则一定有Fe2+
D.若锌粉无剩余, 且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共30分)
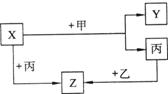 21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
21 (8分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
(1)若甲是具有还原性的金属单质,X、Y、Z中有一种是离子晶体,试推断:
①X、Y、Z中含有丙元素的是 (填写物质的化学式);
②X与甲反应的化学方程式是
(2)若甲是具有氧化性的黄绿色气体单质,丙通常是暗红色的液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子。试推断:
① 甲、乙、丙的化学式。
② 写出X与足量的甲在溶液中完全反应的离子方程式 。
22 (11分)2006年8月末,甘肃省徽县水阳乡有373名儿童被诊断为重度铅中毒。国家环保总局派出专家调查认为,水阳乡新寺村旁的一家铅锭冶炼厂是“罪魁祸首”, 铅锭冶炼厂周边土地已全部被污染。《东方时空》、《焦点访谈》专门对此做了报道,血铅超标的病人正在接受有效治疗。
(1)铅位在周期表的 周期 族,已知+2价铅比+4价铅稳定,即+4价铅有较强的氧化性。
将PbO2与浓盐酸加热产生黄绿色的气体,写出该反应的离子方程式 ,
将SO2通入棕色PbO2的悬浊液会产生白色沉淀,写出该反应的化学方程式 。
(2)铅在自然界主要以方铅矿(PbS)存在,铅锭冶炼厂主要采用火法冶炼铅,其主要过程是先煅烧方铅矿制氧化铅,再用CO还原氧化铅制铅。请写出上述过程有关的化学方程式 , 。
(3)铅蓄电池是最常见的二次电池,它的正极板上覆盖有PbO2,负极板上覆盖有Pb,电解质是H2SO4溶液。请写出电池放电时总反应式 ,放电过程中电解质溶液H2SO4的浓度将变 (填变大、变小或不变),当外电路通过2mol电子时,理论上负极板的质量增加 g。
(4)汽车工业为提高发动机的使用寿命,常在汽油中加入抗震剂四乙基铅,写出四乙基铅的化学式 。近年来我国许多城市禁止汽车使用含铅汽油,其主要原因是 。
23 (11分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。
(1)A2B和A2D的沸点较高者是 (填化学式),其原因是
;
(2)B形成的双原子分子里,从轨道重叠的角度来看共价键的类型有 ;
(3)E原子的电子排布式为: ;
(4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时
间后, 极(填电极名称)附近出现红色;另一极的电极反应式
为 ,可用 检验该极所得产物。电解的总反应方程式
为 。
四、(本题包括3小题,共32分)
24 (9分)[(NH4)2SO4·FeSO4·6H2O]在空气中比一般亚铁盐稳定,是分析化学中常见的还原剂。某研究性学习小组设计了下面的实验装置来制备[(NH4)2SO4·FeSO4·6H2O]。 实验步骤:
(1)把30%NaOH溶液和废铁屑混合、煮沸、冷却,将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得[(NH4)2SO4·FeSO4·6H2O]。
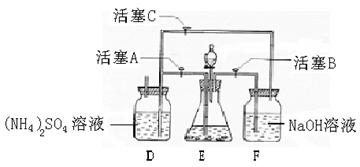
试回答下列问题:
(1)用Fe屑和稀H2SO4反应产生的氢气赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,其目的是 ;操作时应先关闭活塞 ,并同时打开活塞 ;
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用 。
(2)使[(NH4)2SO4·FeSO4·6H2O]结晶的实验操作是:将硫酸亚铁溶液与硫酸铵溶液的混合液转移至蒸发皿中, ,得到[(NH4)2SO4·FeSO4·6H2O]晶体。
(3)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
、 。
25 (11分)某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1) 该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_________________(填“合理”或“不合理”)。
(2) 设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_______,反应的离子方程式为______________________________。
(3) 实验室溶解该熔融物,下列试剂中最好的是____________(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ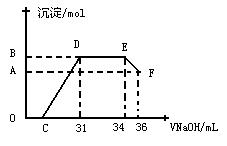 . 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
. 实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1) 图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________ _____。
(2) 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ __;
上述现象说明溶液中 、 、_______结合OH-的能力比________强(填离子符号)。
(3) B与A的差值为_________mol。
26 (12分)新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成 _________________________________ 。
(2)氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:_______________。 实验③:把红色布条放在水里,布条不褪色。 |
________ _________
|
(3)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。
H2CO3 ![]() HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3- + H+ Ka1(H2CO3)
= c(HCO3-)·c(H+)/c(H2CO3)
= 4.45×10-7
HCO3-![]() CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
CO32- + H+ Ka2(H2CO3)
= c(CO32-) ·c(H+)/ c(HCO3-) = 5.61×10-11
HClO ![]() H+ + ClO- Ka(HClO) = 2.95×10-8
H+ + ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
②氯气和碳酸钠按照1︰1的比例恰好反应_____________________________________;
③将过量的氯气通入到少量的碳酸钠溶液______________________________________。
五、(本题包括1小题,8分)
27 (8分))根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,D、E常温下为气体,X常温下为无色无味透明液体,H与E相对分子质量之间的关系为:M(H)-M(E)=34,又知C焰色反应火焰呈紫色,J为红褐色沉淀。
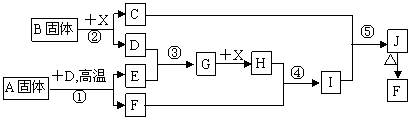 |
(1)固体B的电子式为 ,其中所包含的化学键有 。
(2)固体A的化学式为 ,其中非金属元素的化合价为 。
(3)反应④的离子方程式 。
反应⑤的化学方程式 。
(4)用铜作电极电解H溶液,阳极的电极反应式是 。
(5)已知每生成16gE,放出106.5kJ热量,则反应①的热化学方程式为:
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。)
28 (10分)下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
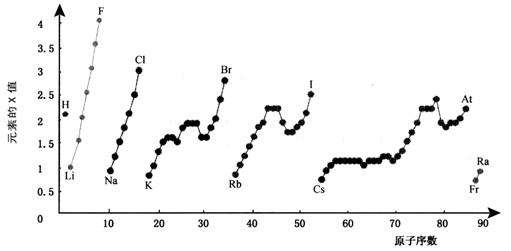
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
c. X值大小可用来衡量元素金属性和非金属性的强弱
29 (10分)下图为周期表中原子体积(单质原子的摩尔体积)随原子序数变化的关系。
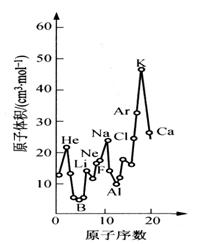
(1)第二周期原子体积最大的元素形成的固态单质属于_________________晶体。第三周期原子体积最小的元素核外电子排布式为_________________________。
(2)试预测下列元素原子体积的关系:Se _____ Br;Xe _____ Ba(选填 >、 = 或 < )。
(3)从图中可以得出的结论有______________(选填代号)。
a. 同一周期中,原子体积先由大变小,而后又由小变大
b. 每一周期中,碱金属的原子体积最大
c. 同一主族中从上到下,原子体积一般总是逐渐减小
(4)由此可见,在元素周期表中,元素性质与它们所形成的单质和化合物的性质均有周期性变化规律。试写出一条Ⅶ族元素所形成的化合物某种性质的变化规律:
_______________________________________________________________。
答卷
姓名 座号 成绩
第Ⅰ卷 (选择题,共70分)
一、二 选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | ||||||||||
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 |
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共30分)
21 (8分)(1)①
② 。
(2)① , ,
② 。
22 (11分) (1) , , ,
。
(2) ,
。
(3)
, 。
(4) ,
23 (11分) (1)__________________,
(2) 。(3)______________ __________。
(4)_____________________________, ,
,
___________ _____ 。
四、(本题包括3小题,共32分)
24 (9分) (1) ,
, ;
。
(2)
。
(3) ,
。
25 (11分) Ⅰ(1)
(2) ,
(3)
Ⅱ(1)
(2) ,
、 、 、
(3)
26 (12分)(1)
(2)
| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色? | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 | ①_____________ ____________。 ②_____________ ____________。 ③____________ _____________。 ④ H2O使布条褪色 | 实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色; 实验②:______________ _。 实验③:把红色布条放在水里,布条不褪色。 |
_______ ______ _
|
(3)①
②
③
五、(本题包括1小题,8分)
27 (1) , (2) ,
(3) ,
(4)
(5)
六、选做题(本题包括2小题,每小题10分,考生只能选做一题。)
28 (10分)(1) 。
(2) ,
,
(3) (4)
29 (10分) (1) , 。
(2) ,
(3) 。
(4) 。
答案
第Ⅰ卷 (选择题,共70分)
一、二 选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | C | A | B | C | B | B | C | B | A | B |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| 答案 | D | BD | AC | A | B | B | D | BD | BC | A |
第Ⅱ卷 非选择题(共80分)
三、(本题包括3小题,共31分)
21 (8分)(1)①CO2、CO ② CO2 + 2Mg == C + 2MgO
(2)①Cl2、Fe、Br2
② 2 Fe2+ + 4Br- + 3 Cl2 = 2 Br2 + 2 Fe3+ + 6 Cl-
22(11分)(1)六、IVA, PbO2 + 2Cl-+ 4H+ == Pb2++ Cl2↑+ 2H2O, SO2 + PbO2 == PbSO4
(2)2PbS + 3O2 == 2PbO + 2SO2 , CO + PbO == Pb + CO2
(3)PbO2 + Pb + 2H2SO4 = 2PbSO4 + 2H2O, 变小, 96
(4)(CH3CH2)4Pb , 避免铅污染大气 (每空各1分,共11分)
23 (11分)(1)H2O ,分子间形成了氢键。(2分) (2)σ键π键 (2分)
(3)1s22s22p63s23p63d104s24p5 (2分)
(4)阴;2Cl——2e—→ Cl2↑ , 湿润的淀粉碘化钾试纸。 (3分)
2NaCl + 2H2O ![]()
![]() 2NaOH + H2↑+Cl2↑ (2分)
2NaOH + H2↑+Cl2↑ (2分)
四、(本题包括3小题,共32分)
24 (9分)(1)防止亚铁盐被氧化(1分); A (1分); B、C (2分);
将E中的产生的硫酸亚铁溶液压入D中(1分)
(2)缓缓加热,浓缩至表面出现结晶薄膜为止,放置冷却,过滤(2分)
(3)用氢氧化钠溶液除去混在氢气中的酸性气体;氢氧化钠溶液重复使用;用氢气驱赶氧气,防止亚铁盐被氧化;等其它合理答案(每空1分,共2分)
25.(11分)
Ⅰ.(1)合理(1分) ⑵NaOH溶液 (1分) 2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑ (1分)
⑶ B(1分)
Ⅱ.⑴H+ + OH -=H2O(1分)
⑵ NH4+ + OH- = NH3·H2O(1分) H+(1分), Al3+(1分),Fe3+(1分), NH4+(1分)。
| |
26 (12分)(1)将盛满氯水的无色矿泉水瓶倒置在水槽中,光照一段时间后,瓶底有无色气体生成。将瓶子倒转过来,用带火星的木条在瓶口检验气体,若木条复燃,证明HClO分解生成的气体为氧气。(4分)
(2)提出假设:①氯气使布条褪色 ②盐酸使布条褪色 ③ HClO使布条褪色 (3分)
验证假设:②把红色布条伸入稀盐酸中,红色布条不褪色 (1分)
结论:次氯酸使布条褪色 (1分)
(3)①![]()
②![]()
③![]() (3分)
(3分)
27(共8分)
(1) 电子式略 离子键 共价键 (2分) (2)FeS2 -1 (2分)
(3) Fe2O3 + 6H+ = 2Fe3+ + 3H2O (1分) Fe2(SO4)3 + 6KOH =2Fe(OH)3↓+3K2SO4 (1分)
(4)Cu-2e-=Cu2+(1分)
(5)FeS2(s)+11/4O2(g)=1/2 Fe2O3(s)+2SO2(g);△H=-852KJ/mol(1分)
28(A)(10分)
(1)O,Mg(2分);
(2)同一主族,从上到下,X值逐渐减小(1分);逐渐增大(1分);周期性(1分);
(3)a(2分);(4)bc(3分)
(B)(10分)
(1)分子(1分);1s22s22p63s23p1(2分); (2)<(1分)、>(1分);(3)ab(3分);
(4)从上到下,气态氢化物稳定性逐渐减弱(答案合理即给分)(2分);