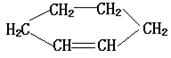08届高三化学上学期周考试题(七)
班级_____姓名______学号____
相对原子质量:H :1 C:12 O:16 P:31 Al:27 Cu:64
一、选择题(每小题只有一个正确答案;共50分,每小题5分)
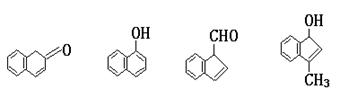
1.下列各组物质中,互为同系物的是 ( )
A. 与 B. 与
C.乙醇与乙二醇 D. 与
2.某有机物的结构简式为: 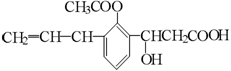 ,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚 ⑧中和
,则此有机物可发生的反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤水解 ⑥氧化 ⑦加聚 ⑧中和
A.①②④⑤⑥⑦⑧ B.②③④⑤⑥⑧ ( )
C.②③④⑤⑥⑦⑧ D.①②③④⑤⑥⑦⑧
3.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”—全氟丙烷(C3F8),并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是 ( )
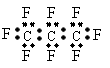 A、分子中三个碳原子可能处于同一直线上
A、分子中三个碳原子可能处于同一直线上
B、全氟丙烷的电子式为:
C、相同压强下,沸点:C3F8<C3H8
D、全氟冰烷分子中既有极性键又有非极性键
4. 可用于鉴别以下三种化合物的一组试剂是 ( )
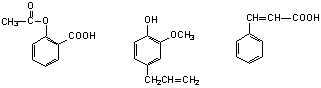
乙酰水杨酸 丁香酚 肉桂酸
① 银氨溶液 ② 溴的四氯化碳溶液 ③ 氯化铁溶液 ④ 氢氧化钠溶液
A.②与③ B.③与④ C.①与④ D.①与②
5.一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,有关此电池的推断正确的是 ( )
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
6.通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱。 ( )
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol—1 | 460 | 360 | 436 | 431 | 176 | 347 |
下列说法中错误的是
A.SiCl4的熔点比SiC低 B.拆开1 mol晶体硅中的化学键所吸收的能量为176kJ
C.HCl的沸点比H2高 D.C—C的键能大于Si—Si
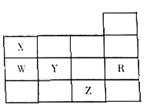 7.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
7.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
( )
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
8.下列说法正确的是 ( )
①标准状况下,22.4LC6H14完全燃烧后,生成的CO2分子数为6NA
②36gD2O2中子总数为18NA
③0.5L 1mol/L的Na2CO3溶液中CO32—数小于0.5NA
④62g白磷分子含有“P—P”共价键总数为3NA
⑤64gCu与足量的硫充分反应转移电子数为2NA
⑥24gAl溶于浓硝酸放出1.5NA个H2分子
⑦电解足量的AgNO3溶液时,每放出22.4LO2(标准状况下)阴极析出4NA个Ag原子
A.①②③④ B.②④⑤⑥ C.③⑤⑥⑦ D.②③④⑦
9.下列说法或表示方法正确的是 ( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s);△H=-1.90 kJ/mol可知,金刚石比石墨稳定
C.在101kPa时,2g H2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l);△H=-285.8 kJ/mol
D.在稀溶液中H+(ag)+OH-(ag)=H2O(l);△H=-57.3 kJ/mol若将含0.5 mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3 kJ
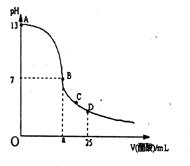 10.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
( )
10.在25mL0.1mol/LNaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如下图所示,有关粒子浓度关系比较正确的
( )
A. 在A、B间任一点(不含A、B),溶液中一定都有
c(Na+)>c(CH3COO—)>c(OH—)>c(H+)
B.在B点,a>12.5,且有c(Na+)==c(CH3COO—)=c(OH—)==c(H+)
C.在C点:c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
D.在D点:c(CH3COO—)十c(CH3COOH)==c(Na+)
二、填空题(共58分)
![]() 11、(10分)在10℃和200KPa的条件下,反应aA(g) dD(g)+
eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度:
11、(10分)在10℃和200KPa的条件下,反应aA(g) dD(g)+
eE(g)建立平衡后,再逐步增大体系的压强(温度维持不变),下表列出不同压强下反应建立平衡时物质D的浓度:
| 压强/ Pa | 200KPa | 500KPa | 1000KPa |
| D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,回答下列问题:
(1)压强从200KPa增大到500KPa时,平衡向 反应方向移动(填“正”或“逆”),其理由是 。
(2)压强从500KPa增加到1000KPa,平衡向 反应方向移动(填“正”或“逆”),其理由是 。平衡之所以向该方向移动,这是由于 。
12.(12分)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,其原理是食盐中的IO3- 与KI溶液发生反应生成的碘单质使淀粉变蓝。表示该反应的离子方程式是:_______________________________ ______ ;
若要确认食盐中还含有K+,具体的方法是________________________________________。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是_________________ __________ _,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
13.(20分)用如图装置进行实验,将A逐滴加入B中:
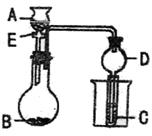
(1)若A为浓硫酸,B为第三周期金属元素的片状单质,其在常温下难与水反应,但在加热时可与水反应,C为品红溶液,实验中观察到溶液褪色,则B是 (写化学式),根据题意写出B与浓H2SO4的化学方程式: ;反应后往烧杯中加入沸水,又可观察到试管C中的现象为 。
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A
应具有的性质是 ,25℃时等物质的量浓度的B、C两溶液pH大的是 (填化学式);然后往烧杯中加入沸水,可观察到试管C中的现象是 。
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,
则A是 (写名称),C是 (写化学式)与乙醛的混合液,写出银镜反应的离子方程式 ,仪器D在此实验中的作用是 。
14. (16分)苏丹红一号(sudanⅠ)是一种偶氮染料,不能作为食品添加剂使用。它是由苯胺和2-萘酚为主要原料制备的,它们的结构简式如下所示:
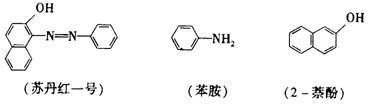
(1)苏丹红-号的化学式(分子式)为
|
|
|
A B C D
(3)上述化合物(C)含有的官能团是
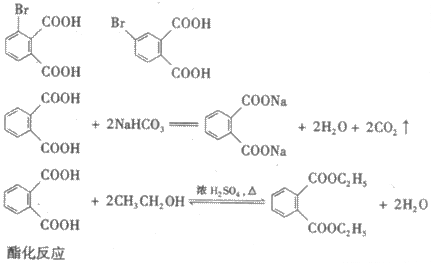
(4)在适当的条件下,2-萘酚经反应可得到芳香化合物E(C8H6O4),1mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8L(标准状况),E与溴在有催化剂存在时反应只能生成两种—溴取代物,两种一溴取代物的结构简式分别是
E与碳酸氢钠反应的化学方程式是
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是
反应类型是 。
周考试题(七)答案
一、选择题(共50分,每小题5分)
1、B 2、D 3、D 4、A 5、C 6、B 7、D 8、D 9、D 10、C
二、填空题(共58分)
11、(共10分,每空2分)
答案:(1)平衡向逆反应方向移动,理由是D浓度增大的倍数(![]() ),小于压强增大的倍数(
),小于压强增大的倍数(![]() ),平衡之所以向该方向移动
),平衡之所以向该方向移动
(2)平衡向正反应方向移动,理由是D浓度增大的倍数(![]() ),小于压强增大的倍数(
),小于压强增大的倍数(![]() ),平衡之所以向该方向移动,是由于压强的增大,产物之一可能转化为固体或液体物质。
),平衡之所以向该方向移动,是由于压强的增大,产物之一可能转化为固体或液体物质。
12. (12分)
⑴IO3-+5I-+6H+=3I2+3H2O (3分) 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+(答取上述反应后溶液进行实验不给分) (2分)
⑵阳极 (2分) I-+3H2O-6e-=IO3-+6H+ (3分) 变大 (2分)
13.(20分,每空2分)
(1)Mg; Mg+2H2SO4 (浓)=MgSO4+SO2↑+2H2O; C中溶液变红
(2)酸性比碳酸的酸性强; Na2CO3;溶液由浑浊变成澄清
![]() (3)浓氨水; AgNO3 ;
(3)浓氨水; AgNO3 ;
CH3CHO+2[Ag(NH3)2]++2OH- CH3COO-+NH4++2Ag↓+3NH3+H2O;
防止倒吸
14、(16分)
(1)C16H12N2O (2分)
(2)(A)(B)(C)(3分)
(3)碳碳双键 醛基(2分)
(4)(2+3分)
(5)(3+1分)
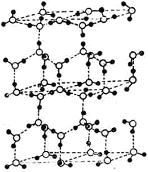 13、水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的分子晶体――冰,其结构示意图如图所示:
13、水分子间存在一种叫“氢键”的作用(介于范德瓦尔斯力与化学键之间)彼此结合而形成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过氢键相互连接成庞大的分子晶体――冰,其结构示意图如图所示:
(1)1mol冰中有 mol氢键。
(2)水分子可电离生成两种含有相同电子数的微粒,其电离方程式为 。
(3)在冰的结构中,每个水分子与相邻的4个水分子以氢键相连接。在冰晶体中除氢键外,还存在范德瓦尔斯力(11kJ•mol-1)。已知冰的升华热是51 kJ•mol-1,则冰晶体中氢键的能量是 kJ•mol-1
(4)用x、y、z分别表示H2O、H2S、H2Se的沸点(℃),则x、y、z的大小关系是 ,其判断依据是______________________________________________________________
________________________________________________________________________。
![]() 13、(1)
2 (2) H2O + H2O H3O+
+ OH-
13、(1)
2 (2) H2O + H2O H3O+
+ OH-
(3) 20 (4) x > z > y 水中含氢键,故沸点最高,硒化氢比硫化氢相对分子质量大,分子间作用力大,故硒化氢沸点高。
24.(1996年上海,30)将等物质的量的A、B、C、D四种物质混合,发生如下反应:
aA+bB![]() cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了
cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了![]() mol,C增加了
mol,C增加了![]() n mol,D增加了n mol,此时达到化学平衡。
n mol,D增加了n mol,此时达到化学平衡。
(1)该化学方程式各物质的化学计量数为a=__________、b=__________、c=__________、d=__________;
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:
A__________、B__________、D__________。
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到相等,则该反应为__________反应(填“放热”或“吸热”)。
24.:(1)2 1 3 2 (2)气态 固态或纯液体 气体 (3)放热