1.(5分)下列实验设计或操作合理的是(多选倒扣分)_____________。
a.中和热测定实验时,如果没有环形玻璃棒,可用环形铜质搅拌棒代替。
b.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度。
c.在250mL烧杯中,加入216mL水和24g NaOH固体,配制10% NaOH溶液
d.向Na2CO3与NaOH的混合溶液中加入足量的CaCl2溶液,再滴加几滴酚酞试液,可检验NaOH的存在。
e.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
f.用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
bde(多选、少选一个扣2分,扣完为止)
2.某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性强弱不同的一元酸与足量镁带反应的速率不同,但是产生的氢气的体积相同,在下图装置的锥形瓶中分别装入1mol•L-1的盐酸和醋酸各10mL,进行实验。
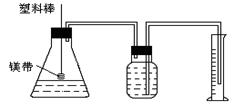
⑴分别称取除去表面氧化膜的镁带ag,并系于塑料棒的末端。则a的数值至少为 g。
⑵除了上图装置中出现的实验仪器和用品外,本实验还需用到的仪器和用品有:天平、100mL量筒、剪刀、胶头滴管、 和 。
⑶在广口瓶中装足量水,按图连好装置后,要 (填操作名称)。
⑷将塑料棒向下移动,使镁条全部浸入酸中,至酸反应完成。
为了比较反应速率和产生氢气的体积,应记录的实验数据为 。
实验结果表明:镁带和盐酸的反应速率比镁带和醋酸的反应速率 (填“快”或“慢”),理由是 。
⑸下列情况中可能导致反应速率变快的是 (填序号,多填扣除分,下同);可能导致产生氢气的体积减少的是 。A.镁带中含有少量跟酸不反应的杂质
B.没有除去镁带表面的氧化膜 C.镁带中含有少量的杂质铁
(12分)⑴0.12(2分)⑵砂纸、计时器(2分)⑶检查装置的气密性(1分)
⑷反应开始至气泡停止冒出的时间(1分),排入量筒水的体积(1分),快(1分),同浓度的盐酸比醋酸溶液中的H+浓度大(1分)⑸AC(2分,漏选得1分,多选0分),B(1分)
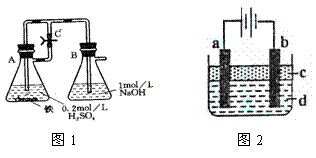
2.(本题共14分)某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
 【实验设计】
【实验设计】
方法一:按照图1进行实验,容器A中的反应开始时,弹簧夹C处于打开状态,一段时间后,关闭弹簧夹C,容器A中的反应仍在进行。最终在_______容器中观察到白色沉淀,该实验中涉及到的化学方程式有: 。
方法二:按图2进行实验,最终在两极间的溶液中首先观察到白色沉淀。请从所提供的试剂或电极材料中选择正确的序号填在横线上:①纯水 ②NaCl溶液 ③NaOH溶液 ④四氯化碳 ⑤CuCl2溶液 ⑥乙醇 ⑦Fe棒 ⑧植物油 ⑨碳棒
a为___________,b为___________,c为___________,d为___________。(填序号)
【探究思考】实验表明上述实验中出现白色的沉淀会逐渐转变为灰绿色或绿色,那么如何解释出现灰绿色或绿色的现象呢?
(1)甲同学查阅资料后,得到Fe(OH)2如下信息:
| 资料名称 | 物理性质描述 | 化学性质描述 |
| 《化学辞典》,顾翼东编,1989年版P637 | 白色无定形粉末或白色至淡绿色六方晶体 | 与空气接触易被氧化,将细粉喷于空气中,则立即燃烧出火花 |
| 《大学普通化学(下册)》傅鹰著P637 | 白色沉淀 | 此沉淀易被氧化成微绿色Fe3(OH)8 |
| 《普通化学教程》(下册)P788 | 白色 | 能强烈吸收O2,迅速变成棕色Fe(OH)3。这时作为氧化的中间产物为土绿色,其中含有Fe2+、Fe3+。 |
阅读该资料后,你对上述实验中出现灰绿色或绿色的现象的解释是:__________ ;资料中提及的微绿色Fe3(OH)8,用氧化物的形式表示可写成__________________。
(2)乙同学依据配色原理:白色和棕色不可能调配成绿色或灰绿色的常识,认为绿色可能是形成Fe(OH)2·nH2O所致。用热水浴的方式加热“方法一”中生成的绿色沉淀,观察到沉淀由绿变白的趋势。
加热时,“方法一”中弹簧夹C应处于___________(填“打开”或“关闭”)状态,容器A中的反应须处于___________(填“停止”或“发生”)状态。写出该实验中支持乙同学观点的化学方程式_______________。
(3)欢迎你参加该研究小组的讨论,请提出一种在研究由Fe2+制备Fe(OH)2的过程中,有助于对沉淀由“白”变“绿”的现象进行合理解释的实验设计新思路。 。
【实验设计】方法一:B;Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+2H2O 中和反应方程式不写不扣分
方法二:⑦、⑨或⑦、⑧、②。(每空1分,共6分)
【探究思考】(1)(共3分)由于Fe(OH)2部分被氧化,混入少量的Fe(OH)3(1分)。
|
(2)(共3分,各1分)打开,发生,Fe(OH)2·nH2O= Fe(OH)2+ nH2O。
(3)(共2分)向Fe2+和Fe3+的混合液中加入NaOH溶液后,观察生成的沉淀的颜色是否为灰绿色(或者可以将Fe(OH)3和Fe(OH)2混合后观察其颜色。)(合理答案均给分)