高三化学第一学期8月月考试卷
化 学 试 卷
考试时间100分钟 满分120分
可能用到的相对原子质量:Ar(H)=1 Ar(O)=16 Ar(C)=12 Ar(Mg)=24 Ar(Ca)=40 Ar(Fe)=56 Ar(Cu)=64 Ar(Al)=27 Ar(N)=14 Ar(Cl)=35.5 Ar( Na)=23 Ar(K )=39 Ar( S)=32 Ar( Al)= 27 Ar( Ba)=137
一、选择题(每题只有1个正确答案,每小题3分,共30分)
1.2004年2月22日是第35个“世界地球日”,我国确定的主题是“善待地球——科学发展”,下列行为中不符合这一主题的是 ( )
A.采用“绿色化学”工艺,使原料尽可能转化为所需要的物质
B.大量开采地下水,以满足社会对水的需求
C.减少直至不使用对大气臭氧层起破坏作用的氟氯烃
D.节约能源,提高能源利用率
2.张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。这是相对原子质量表中首次采用我国测定的相对原子质量值。则下列关于In的说法中,错误的是 ( )
A.![]() In原子核外有49个电子
In原子核外有49个电子
B.![]() In原子核内有49个中子
In原子核内有49个中子
C.![]() In原子核内质子数和中子数之和等于其质量数,为115
In原子核内质子数和中子数之和等于其质量数,为115
D.![]() In是In元素的一种核素
In是In元素的一种核素
3.下列物质按不同类别分组,所得组合最不合理的是 ( )
(1)糖类(2)塑料(3)石油(4)蛋白质(5)合成纤维(6)棉花(7)陶瓷(8)玻璃(9)天然气(10)水泥
(11)合成橡胶(12)煤(13)油脂(14)羊毛
A.(1)(4)(13) B.(2)(5)(11) C.(7)(8)(11)(14) D.(3)(9)(12)
4.下列各组微粒中,核外电子总数相等的是 ( )
A.Na+和Li+ B.CO和CO2 C.H2O 和Al3+ D.NO和CO
5.通过化学反应不能实现的是 ( )
A.生成一种新离子 B.生成一种新分子
C.生成一种新核素 D.生成一种新单质
6.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是 ( )
A.KMnO4 B.NaClO C.H2O2 D.Cl2
7.存放下列试剂的方法中,有错误并且会引起危险的是: ( )
A.白磷浸在盛有CS2的敞口试剂瓶中
B.金属钠浸在盛有煤油的试剂瓶中
C.碳酸钠饱和溶液放在带玻璃塞的试剂瓶中
D.溴水放在带橡皮塞的试剂瓶中
8.配置250mL0.5mol/L的NaOH溶液,有下列仪器:①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500mL容量瓶、⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚,需要用到的仪器有 ( )
A.①③④⑥⑨⑩ B.①④⑦⑧⑨⑩
C.①③④⑦⑧⑨ D.①②④⑤⑧⑨
9.下列各组在溶液中反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHCO3与Ca(OH)2
10.t℃时,将一定量A(不含结晶水)的不饱和溶液均分为三份,分别加热蒸发,然后冷
却至t ℃,已知三份溶液分别蒸发水的质量为10g、20g、30g,析出A晶体(不含结晶水)
|
A.c = a + b B.c = 2b-a C.c = a + 2b D.c = 2a-b
二、选择题(每题有1-2个正确答案, 每小题4分,共32分)
11.设NA代表阿伏加德罗常数,下列说法正确的是 ( )
A.用惰性电极电解500mL饱和食盐水时,若溶液的pH值变为14时,则电极上转移的电子数目为NA
B.在铜与硫的反应中,1mol铜失去的电子数为2 NA
C.标准状况下,22.4L甲烷和乙炔混合物所含的分子数为NA
D.46g 二氧化氮和46g四氧化二氮含有的原子数均为3NA
12.下列各组离子在相应的条件下可以大量共存的是 ( )
A.在碱性溶液中:CO32—、K+、C1—、Na+
B.与铝粉反应放出氢气的无色溶液中:NO3—、Mg2+、Na+、SO42—
C.在c(H+)/c(OH—)==1×1012的溶液中:NH4+、Ca2+、C1—、K+
D.在中性溶液中:Fe3+、S2—、NO3—、A13+
13.下列各项实验操作中,正确的是 ( )
A.为使制取H2的速率加快,可向H2SO4中加少量CuSO4溶液
B.为加快过滤速度,可用玻璃棒搅拌过滤器中的食盐水
C.配制一定物质的量浓度的溶液时,容量瓶用水洗涤后再用所配溶液洗涤
D.为除去试管内壁上的“银镜”,可用氨水洗涤
14.质量分数为a%,物质的量浓度为c mol/L 的KOH溶液,蒸发溶剂,恢复到原来温度,若质量分数变为2a%,则物质的量浓度变为 ( )
A.等于2c mol/L B.大于2c mol/L
C.小于2c mol/L D.在c mol/L∽2c mol/L之间
15.下列反应的离子方程式书写正确的是 ( )
A.碳酸氢钙溶液中加入过量的NaOH溶液:
Ca2++HCO3-+OH-=CaCO3↓+H2O
B.溶液中NH4HSO3与NaOH等物质的量混合:
NH4++HSO3-+2OH-=SO32-+NH3·H2O+H2O
C.过量的CO2通入NaAlO2溶液中:
CO2+2H2O+AlO2-=Al(OH)3↓+HCO3-
D.硫化钠溶于水中:S2-+H2O=HS-+OH-
16.200C时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法不正确的是 ( )
A.250C时,饱和KCl溶液的浓度大于4.0 mol·L-1
B.此溶液中KCl的质量分数为![]()
C.200C时,密度小于1.174g·cm-3的KCl溶液是不饱和溶液
D.将此溶液蒸发部分水,再恢复到200C时,溶液密度一定大于1.174g·cm-3
17.下列各组溶液,不用其他试剂就不能鉴别的是 ( )
A.FeCl3、NaNO3、Na2CO3、NaCl B.NaOH、MgSO4、Na2CO3、NaHSO4
C.AgNO3、KNO3、KCl、NaI D.HCl、BaCl2、NaOH、CuSO4
18.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)( )
A.7∶1 B.7∶2 C.7∶3 D.7∶4
|
19.(6分)可用于分离或提纯物质的方法有:
A.分馏 B.盐析 C.过滤 D.重结晶 E、升华 F、渗析 G、电解
H、加热分解 I、蒸馏 J、灼热氧化。如欲分离或提纯下列各组混合物,请选择上
述方法中最合适者,并将相应字母填入题后空格内:
(1)从石油中分离出汽油和煤油等成分
(2)除去淀粉溶液中的少量碘化钠
(3)从油脂皂化反应后的混合液中分离出高级脂肪酸钠
(4)除去粗铜中锌、银等金属
(5)除去水中的Na+、SO![]() 、Cl-等杂质
、Cl-等杂质
(6)除去KNO3晶体中混有的少量NaCl
20.(7分)位于短周期的四种主族元素A.B.C.D原子序数依次增大,已知A.C位于同一主族,A在周期表中原子半径最小。B.D的最外层电子数相等,且B.D的原子序数之和为A.C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式
, , , 。
(2)C与D形成D的最低价化合物的电子式:______
(3)仅由B.C.D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因:______ 。
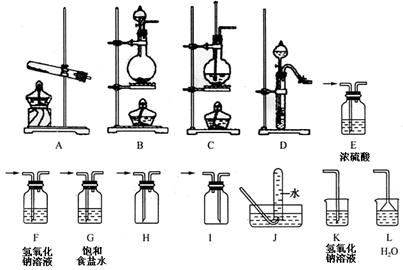
21.(8分)某校化学课外活动小组组装了下列仪器,如图所示。欲经过简单连接,制备中学化学中几种常见气体。
请填写下列表格中的空白:
|
| 序号 | 气体 | 装置的连接顺序(用编号表示) | 按要求填试剂名称 | 实验室制备该气体的化学反应方程式(是离子反应的要写出离子反应方程式) |
| (1) | CO2 | 制备→收集 ( )→( ) | ||
| (2) | NH3 | 制备→收集→尾气处理 ( )→( )→( ) | 若干燥NH3可选用的试剂
| |
| (3) | Cl2 | 制备→净化→干燥→收集 →尾气处理 ( )→( )→( ) →( )→( ) | 处理尾气的试剂
|
22.(12分)(1)已知下列反应在一定条件下可以发生:
H2O2+4Fe2++2H+ 2Fe3++2H2O H2O2+2Fe3+ 2Fe2++O2↑+2H+
在以上反应中Fe2+实际上起着 作用,总反应为 。
(2)I2与Fe2+一样也能发生上述类似反应,类比(1)写出合适的化学反应方程式:
H2O2+I2 2HIO,
,总反应为
。
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,
并可以使淀粉溶液变蓝。有学生认为该反应的离子方程式为:H2O2+2I- I2+O2↑+2H+,这个方程式正确吗?
。若正确,理由是(若认为不正确,该步不必作答)
。若不正确,写出正确的化学反应方程式(若是离子反应,写出离子反应方程式,没有离子反应的,写出化学反应方程式):
。
23.(10分)已知单质铁溶于—定浓度的硝酸溶液中反应的离子方程式为:
aFe+bNO3—+cH+=dFe2++fFe3++gNO↑+hN2O↑+kH2O(化学计量数a~k均为正整数)。
回答下列问题:
(1)根据反应中氮、氢、氧三种元素的原子个数守恒,可得C.g、h的关系式是(用—个代数式表示。下同) 。
(2)根据反应中离子的电荷守恒,可得B.C.D.f的关系式是 。
(3)根据反应中电子转移的总数相等,可得D.f、g、h的关系式是 。
(4)若a=12,且铁和稀硝酸恰好完全反应,则b的取值范围是 ;
c的取值范围是 。
四、计算题
24.(5分)一定质量的氧化镁和氧化钙的混合物刚好与10倍质量的盐酸完全反应,试求盐酸中溶质的质量分数。
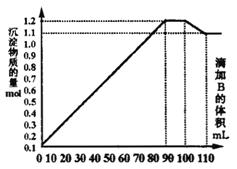 25.(10分)向100mLBaCl2、AlCl3和FeCl3的
25.(10分)向100mLBaCl2、AlCl3和FeCl3的
混合溶液A中,逐滴加入Na2SO4和NaOH
的混合溶液B,产生的沉淀总物质的量和加
入溶液B的体积关系如右图所示:
(1)当加入B溶液110 mL时,溶液中的
沉淀是______________(填化学式)。
(2)溶液B中Na2SO4与NaOH的物质的
量浓度之比____________;从90 mL至
100 mL之间加入10 mL B溶液时所发生
的离子反应方程式是_________ 。
(3)将A.B溶液中各溶质的物质的量浓度填入下表:
| 溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
| 浓度 |
参考答案
一、
1.B 2.B 3.C 4.C 5.C 6.B 7.A 8.C 9.B 10.B
二、
|
三、
19.(A)(F)(B)(G)(I)(D)
![]() 20.(1) SO2 O3 H2O2 Na2O2
20.(1) SO2 O3 H2O2 Na2O2
(2)
![]() (3) SO32-+H2O HSO3-+OH-
(3) SO32-+H2O HSO3-+OH-
21
|
(2)A→I→L 碱石灰(或NaOH固体) Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O
|
|
|
|
(3)不正确 H2O2+2I-+2H+ 2H2O+I2,2H2O2 2H2O+O2↑
23.(1)c= 4g+10h (2)c-b=2d+3f (3)2d+3f=3g+8h
(4)6<b<12 (5)30<C<48
四、
24.13.04%<ω(HCl)<18.25%
25.(1)BaSO4 Fe(OH)3 (2) 1∶1 Ba2+ + SO42- = BaSO4↓
Al(OH)3 + OH- = AlO2- + 2H2O
(3)10 10 10 2 1