08届高三化学11月月考试卷
可能用到的相对原子质量
H-1 C-12 N-14 O-16 Na-23 Si-28 P-31 S-32 Cl-35.5 K-39 Cu-64
第Ⅰ卷(选择题,每小题只有一个选项符合题意,36分)
1.设NA表示阿佛加德罗常数的值,下列关于NA的下列说法中正确的是
A.铁粉与一定量浓硫酸反应,产生11.2LSO2和1gH2,铁粉失去的电子数为2NA
B.124g白磷中含有P—P键的数目为4NA
C.含2NA个化学键的CnH2n+2分子的物质的量为2/(3n+1)mol
D.7.8gNa2S溶于水中,S2-的数目为0.1NA
 2.不能用勒沙特列原理解释的是
2.不能用勒沙特列原理解释的是
A.经粉碎的黄铁矿在沸腾炉中燃烧得较快、较完全
B.饱和FeCl3溶液中加入盐酸,丁达尔效应减弱
C.NaOH溶液使酯水解比稀H2SO4使酯水解效果好
D.氨水的保存需要密封、低温保存
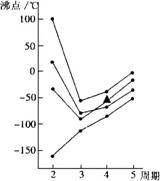
3.右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化(外压为1atm),其中▲代表的是
A.AsH3 B.HBr C.H2Se D.GeH4
4.通过复习总结,你认为下列对化学知识的概括合理的是
A.氧化物不可能是还原产物,只可能是氧化产物
B.一种元素可能有多种氧化物,但相同化合价只对应一种氧化物
C.原子晶体熔点不一定比金属晶体高,分子晶体熔点不一定比金属晶体低
D.原子晶体、离子晶体、金属晶体、分子晶体的粒子之间都一定存在化学键
5.下列关于接触法制硫酸的叙述中正确的是
A.为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收
B.由于高压的条件有利于SO2转化为SO3,所以SO2接触氧化采用高压的反应条件
C.为提高SO3的吸收效率,吸收操作采取逆流形式,SO3从吸收塔的下部通入
D.在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
6.K35ClO3晶体与H37Cl的溶液反应后,生成氯气、氯化钾和水。下列说法正确的是
A.生成氯气的相对分子质量为72
B.被还原的K35ClO3和被氧化的H37Cl的物质的量之比为1:6
C.氯化钾既不是氧化产物,也不是还原产物
D.每生成标准状况下的氯气11.2L,转移的电子数约为6.02×1023
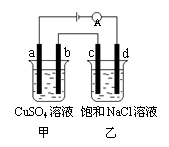 7.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
7.如图所示,a、b、c、d均为石墨电极,通电进行电解。下列说法正确的是
A.乙烧杯中d的电极反应为 2Cl––2e– =Cl2↑
B.a、c两极产生气体的物质的量相等
|
2NaCl + 2H2O ![]() 2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
D.甲、乙两烧杯中溶液的pH均保持不变
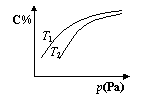 8.在密闭容器中,对于可逆反应A+3B
8.在密闭容器中,对于可逆反应A+3B![]() 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
A.若正反应方向△H <0,则T1> T 2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
9.一定量的铜与一定量的浓硝酸恰好完全反应,产生NO、NO2两种气体(不考虑2NO2![]() N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为
N2O4),已知反应中被还原的HNO3占HNO3总量的1/3,则还原产物中NO、NO2的物质的量之比为
A.2∶1 B.1∶2 C.2∶3 D.1∶1
10.将下列每组内的四种物质同时加入到水中,充分搅拌后,既有氧化还原反应发生,又有沉淀产生的一组是(酸均过量)
A.Na2O2、NH4Cl、NaCl、Na2SO4 B.FeO、AlCl3、Na2SiO3、硝酸
C.KHCO3、Ca(OH)2、MgCl2 、硫酸 D.Na2CO3、BaCl2、K2S、盐酸
| 化学键 | Si—O | O=O | Si—Si |
| 键能/kJ·mol-1 | X | 498.8 | 176 |
11.有关键能数据如表:
晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)=SiO2(s);![]() = -989.2/kJ·mol-1,则X的值为
= -989.2/kJ·mol-1,则X的值为
A.423.3 B.460 C.1165.2 D.920
12.某溶液中加入铝粉产生的气体只有氢气,该溶液中肯定可以大量存在的离子组是
A.Na+、NO3-、Cl-、SO42- B.Na+、K+、Ba2+、HCO3-
C.Na+、K+、Cl-、SO42- D.Fe3+、H+、SO42-、Cl-
13.X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期, W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.X与W可以形成W2X、W2X2两种化合物
C.原子半径由小到大的顺序为:W<X<Z<Y
D.Y、Z两种元素气态氢化物中,Z的气态氢化物最稳定
14.利尿剂是2008北京奥运会违禁药物,顾名思义,此类药物有稀释尿液的功能。利尿剂现有15种,主要用于掩盖或“清洗”体内其它违禁药品的存在,以逃避兴奋剂检查。下图所示有机物是其中之一的结构简式:
![]()
下列叙述正确的是
A.1mol利尿酸最多可与5mol H2发生加成反应
B.利尿酸分子式是C11H12O4
C.利尿酸分子中位于同一平面内的原子有10个
D.利尿酸与新制Cu(OH)2悬浊液反应有红色沉淀生成
15.镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
![]() MgxMo3S4
x Mg + Mo3S4
MgxMo3S4
x Mg + Mo3S4
在镁原电池放电时,下列说法错误的是
A.Mg2+向正极迁移 B.正极反应为:Mo3S4 + 2xe- = Mo3S42x-
C.Mo3S4发生氧化反应 D.负极反应为:xMg-2xe- = xMg2+
16.两个体积相同的密闭容器A和B,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,加热到相同温度,发生如下反应:2SO2(气)+O2(气)![]() 2SO3(气),对此反应的下列说法不正确的是
2SO3(气),对此反应的下列说法不正确的是
A.反应速率:B>A B.SO2的转化率B>A
C.平衡时各组分含量:B=A D.平衡时容器内压强B>A
17.t℃时,NaCl的溶解度为ag,取该温度下的饱和氯化钠溶液VmL,测得其密度为ρg/cm3,则下列表达式正确的是
A.w (NaCl)=![]() B.n (NaCl)=
B.n (NaCl)=![]()
C.n (NaCl)= ![]() D.c (NaCl)=
D.c (NaCl)=![]()
18.运用元素周期律分析下面的推断,其中错误的是:①铍(Be)的最高价氧化物的水化物可能具有两性;②铊(Tl)既能与盐酸作用产生氢气,又能跟NaOH溶液反应放出氢气,Tl(NO3)3溶液的酸性很强;③砹(At)为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水也不溶于稀酸;④锂(Li)在氧气中剧烈燃烧,产物是Li2O2,其溶液是一种强碱;⑤硫酸锶(SrSO4)是难溶于水的白色固体;⑥硒化氢(H2Se)是无色,有毒,比H2S稳定的气体。
A.①②③④ B.②④⑤ C.①③⑤ D.②④⑥
班级 姓名 学号 成绩
请将Ⅰ卷的答案填入下表中
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | |||||||||
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(非选择题,共64分)
19.(11分)分别取40mL的0.50mol/L盐酸与0.55mol/L氢氧化钠溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出表示稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式 ;
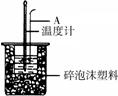 (2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的
(2)如右图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的![]() (填“偏大”、“偏小”或“无影响”);
(填“偏大”、“偏小”或“无影响”);
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4.18J/(g·℃)。为了计算中和热,实验时还需测量的数据有(填序号)__________;
A.反应前盐酸溶液的温度 B.反应前盐酸溶液的质量
C.反应前氢氧化钠溶液的温度 D.反应前氢氧化钠溶液的质量
E.反应后混合溶液的最高温度 F.反应后混合溶液的质量
(4)某学生实验记录数据如下:
| 实验序号 | 起始温度t1℃ | 终止温度t2℃ | |
| 盐酸 | 氢氧化钠 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热![]() =____________________;
=____________________;
(5) (填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是 。
|
|
![]()
|
4CuO======2Cu2O+O2 2SO3 2SO2 + O2
取一定量硫酸铜晶体(CuSO4·XH2O)置于已知质量的坩埚中称重,测得硫酸铜晶体的质量为ag。用酒精灯将坩埚充分加热,然后放入干燥器中冷却,再称重。经若干次加热、
班级 姓名 学号
冷却称重,直到质量基本不变,称得坩埚中剩余固体物质的质量为bg。
(1)在上述实验操作中,至少称量 次。
(2)该晶体中x的实验值为________________________________________。
(3)将实验值与根据化学式(CuSO4·5H2O)计算的结果比较,实验值大于计算值,造成误差的原因可能是____________________。
a.实验中部分固体溅出 b.加热温度过高
c.部分样品已风化 d.硫酸铜晶体中含有不挥发性杂质
(4)另取25.0g胆矾(CuSO4·5H2O),缓慢升温到1000℃,
①在加热过程中,当固体物质的质量为10.0g时,该固体可能的组成是(用化学式表示)___________________________。
②在1000℃时,除水外,其余气态产物物质的量(n)的取值范围是(不考虑实 验误差)___________________________________________。
21.(14分)有机物A能发生如下图所示的变化。其中,C能使溴的四氯化碳溶液褪色,D不含甲基,在一定条件下能发生消去反应。
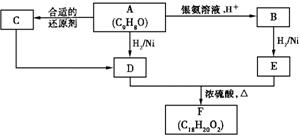
填写下列空白:
(1)A分子中的含氧官能团的名称为 ,C的结构简式是 。
(2)C→D的反应类型是 (填标号)。
a.氧化反应 b.还原反应 c.加成反应 d.取代反应
(3)D+E→F的化学方程式是 。
(4)与D分子式相同,其中能与金属钠反应且苯环上有一个取代基(包括D)的同分异构体有 种。
(5)A~F六种化合物中能与金属钠反应,但不能与氢氧化钠反应的是 (填标号,下同);燃烧时消耗的氧气和生成的CO2、H2O之间物质的量之比为11:9:5的是 。
22.(11分)核电荷数由小到大顺序排列的五种短周期元素X、Y、Z、W、Q。其中:在同周期元素中,Z的金属性最强,Q的非金属性最强;W的单质是淡黄色固体;X、Y、W在周期表中的相对位置关系如图所示:
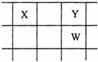
| |
(2)这五种元素中,原子半径最大的是 (填化学式);由Z、W、Q形成的简单离子半径由大到小的顺序是 (用化学式表示);X、W、Q的最高价氧化物的水化物酸性从强到弱的顺序为 (用化学式表示);
(3)Y和Z形成的一种化合物中含有离子键和共价键,写出该化合物与水反应的化学方程式 ;
(4)写出由W所在主族元素形成的含有18e-的四原子氢化物的电子式 ;
(5)由X、Y和氢三种元素组成的化合物X6H12Y6,已知:9g该化合物燃烧生成XY2和液态H2Y时,放出140kJ的热。写出该化合物燃烧热的热化学方程式:
。
23.(7分)将1 mol I2(g)和2mol H2(g)置于某2L密闭容器中,在一定温度下发生反应:I2(g) + H2(g) ![]() 2HI(g);
2HI(g);![]() <0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
<0,并达到平衡。HI的体积分数Φ(HI)随时间变化如图中曲线(Ⅱ)所示:
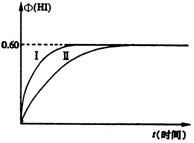 (1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
(1)达平衡时,I2(g)的物质的量浓度为______mol · L – 1。
(2)若改变反应条件,在某条件下Φ(HI)的变化如曲线(I)所示,则该条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c应满足的关系为_________________(用一个含a、b、c的代数式表示)。
24.(12分)用石墨电极电解200mL0.5mol/L的NaCl溶液,阳极收集到2.24L(标准状况)气体时,停止通电。请回答以下问题:
(1)电解过程中阳极的电极反应分别为 、 ;
(2)阴极生成的气体体积为 L(标准状况);
(3)若将阳极生成的气体通入电解后的溶液中,充分反应后,则所得溶液中离子的浓度由大到小依次是 ;
(4)常温下,若将电解后的稀溶液稀释至1L,则溶液的pH约为 ;
(5)若将电解后阳极所产生的气体全部通入1mol/L500mLNa2SO3的溶液中,使之充分反应(假设溶液的体积变化忽略不计),则所得溶液中SO42-的物质的量浓度最多为 mol/L。
参考答案及评分标准
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | C | A | A | C | C | C | C | C | D |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | B | C | B | B | C | C | C | D |
19.(1)NaOH(aq1/2)+1/2H2SO4(aq)=1/2Na2SO4(aq)+H2O(l);![]() =-57.3kJ/mol 2'
=-57.3kJ/mol 2'
(2)环形玻璃搅拌棒 1' 偏大 1'
(3)A、C、E 3'
(4)![]() =-51.8kJ/mol 2'
=-51.8kJ/mol 2'
(5)不能 1' 还发生了Ba2+和SO42-的反应,也会有热效应 1'
20.(1)3 1'
(2)80(a-b)/9b 2'
(3)a、b 2'
(4)CuSO4、CuO(都答对得2') 0.125 mol<n<0.175mol 2'
21.(1)醛基 1'
![]() 2'
2'
(2)b、c 2'
(3)![]() +
+![]()
![]()
![]() +H2O 3'
+H2O 3'
(4)5 2'
(5)C、D 2' C、F 2'
22.(1)金刚石 1'
(2)Na;1' S2—>Cl—>Na+ 2' HClO4>H2SO4>H2CO3 2'
(3)2Na2O2+2H2O=4NaOH+O2↑ 2'
(4)![]() 1'
1'
(5)C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(1);△H=-2800kJ/mol 2'
23.(1)0.05; 2 '
(2)③⑤ 2'
(3)2b-4a=c 3'
24.(1)2Cl-—2e-=Cl2 ↑ 2 ' 4OH-—4e-=O2 ↑+2H2O 2 '
(2)3.36 2'
(3)c(Na+)> c(Cl-)>c(ClO-)>c(OH-)>c(H+) 2'
(4)13 2' (5)0.3 2'